Цель семинара
Сформировать компетентность учащихся по данной теме на основе межпредметных связей (физика + химия) в умении применять знания.
Задачи
1) Обобщить материал по теме «Атомная физика».
2) Продолжить формирование научного мировоззрения.
3) Совершенствовать навыки решения задач.
4) Формировать критическое, логическое мышление, адекватную самооценку.
5) Активизировать работу с научно – популярной литературой, тестами, подготовку к ЕГЭ.
Оборудование и техническое обеспечение
Компьютер, мультимедиапроектор, диск «Атом, молекула» (химия), тесты – листы – задания на парту, сборники задач Л.А. Кирик и А.П. Рымкевич, портреты ученых Э.Резерфорд, М. Складовская – Кюри,И.В.Курчатов, Д.И.Менделеев, Н.Бор.Таблицы по химии: «Модель Томсона», «Модель Резерфорда», «Орбитали», таблицы по физике: «Модель Бора».
Оформление класса
«Ядерная физика и в особенности физика элементарных частиц являются
наиболее глубокими разделами физической науки».
А.Наумов.
«В каждом атоме незримо полыхает Хиросима».
Э.Балашов.
«Дайте мне материю, и я построю из нее мир».
И.Кант.
Девиз урока
«Границ научному познанию и предсказанию предсказать невозможно».
Д.И.Менделеев.
Ход урока
1. Оргмомент : готовность класса, доски, наличие раздаточного материала на партах.
2. Вступительное слово учителя
(форма урока, цели, задачи зачитать по слайдам; обратить внимание на оценочный лист, т.к. по ним оценивается рейтинг).
Уч. физ. Мир материален. Материя – все, что существует на Земле и вне Земли, в Мире.
Вопрос: Что такое материя? Какие виды материи вы знаете?
Ответ : (слайд 2, приложение1)
Материя
Вещество Поле
Молекулы
Атомы
Ядро + Электроны е-
Протоны Нейтроны
р+ пО
Более глубоко поговорим об атоме и его структуре.
3. Основная часть урока
Уч. хим.
Исторический материал
Понятие «атом» пришло к нам из далекой античности, но совершенно изменило тот первоначальный смысл, который вкладывали в него древние греки. В переводе с греческого «атом» означает «неделимый». Энтомология названия «неделимый» отражает сущность атома с точностью. Атом делим и состоит из элементарных частиц.
Уч. физ.
Вопрос: Какими великими открытиями доказана сложность строения атома?
Ответ: Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX и начале XX в результате изучения природных лучей (Дж. Томсон 1897 г.), открытия явления фотоэффекта (А.Г.Столетов 1889 г.), открытия радиоактивности химических элементов (Беккерель, М. Складовская – Кюри 1896-1899 гг.), определения природы - частиц (эксперименты Э.Резерфорда 1889 – 1900 гг.).
Уч. хим.
Вопрос: (Слайд3) Как же развивалась классическая теория строения атома?
Ответ: (Слайд 3) Гипотеза Джозефа Томсона о структуре атома – первая попытка объединить имевшиеся научные данные о сложном составе атома в модель «атома».
В 1904 г. в работе «О структуре атома»Томсон дал описание своей модели получившей название «сливового пудинга» или «кекса с изюмом».
В этой модели атом подобен сферической массе пудинга с положительным зарядом, внутрь сферы вкраплены отрицательно заряженные «сливины» или «изюмины» как капли - электроны. Поэтому модель Томсона называется «капельная». Электроны совершают колебательные движения, благодаря которой атом излучает энергию. Атом в целом электронейтрален.
Модель Томсона не была подтверждена экспериментально и оставалась только гипотезой.
Представление о составе атома и движении электронов в нем вошли в модель атома Эрнеста Резерфорда.
Уч. физ.
Вопрос: (слайд 4). Каков же атом по теории Резерфорда?
Ответ: Планетарная модель атома Резерфорда (1911 г.) согласно которой атом состоит из положительного заряженного ядра, вокруг которого вращаются электроны по замкнутым орбитам, подобно движению планет вокруг Солнца.
Э.Резерфорд - основоположник современного учения об атоме - построил наглядную теоретическую модель атома, которой формально мы пользуемся и сейчас.
Классическая теория Резерфорда не могла объяснить излучение и поглощение энергии атомов.
Уч. хим.
Вопрос: (слайд 5). И поэтому в 1913 г. было создано новое учение, учение кого?
Ответ: В 1913 г. квантовые постулаты Бора внесли в планетарную модель Резерфорда квантовые представления. Постулаты опирались на теоретические идеи М.Планка и А.Эйнштейна (1905 г.) (слайд 6,7)
I постулат гласит: Электрон вращается вокруг ядра по строго определенным замкнутым орбитам в соответствии с разрешенными значениями энергии Е1, Е2 ….
И атом в стационарном состоянии энергии не излучает.
II постулат гласит: Электрон переходит из одного разрешенного энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Уч.физ
Вопрос: Какая формула для второго постулата Бора есть в физике?
Ответ:
Ε=Εĸ-Εп hν=Εĸ-Εп Εĸ>Εп
Уч. физ.
Вопрос: В чем сущность теории, разработанной в 1932 г. Иваненко и Гейзенбергом?
Ответ: В это время была разработана теория протонно – нейтронной модели ядра.
Согласно которой ядро состоит из протонов и нейтронов, между которыми проявляются ядерные силы. Заряд ядра равен числу протонов, по модулю равен суммарному заряду всех электронов. Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра, образованного из протонов и нейтронов, и электронов вращающихся вокруг ядра.
Итак: Электроны, протоны, нейтроны называют элементарными частицами.
Уч. физ.
Вопрос: Каковы же свойства этих частиц?
Ответ: Так как частицы имеют массу и размеры они несут свойства объектов микромира, т.е. корпускулярным.
Квантовая механика характеризует элементарные частицы как объекты микромира двойственной природы - корпускулярно-волновым дуализмом, т.е. они являются одновременно и частицами (корпускулами) и волнами.
λ=h÷(m·v)
Уч. физ.
Вопрос: (слайд8, 9). Каково же состояние электронов в атоме?
Ответ: Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Электрон не имеет траектории, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
Часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (равна 90%) называется атомной орбиталью.
Для характеристики орбиталей используют квантовые числа.
Энергия и размер орбитали и электронного облака характеризуется главным квантовым числом - n. Главное квантовое число принимает значение целых чисел от 1 до ∞, n = 1, 2, 3, 4……
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Значение n 1 2 3 4 5 6 7
Обозначения уровня K Z M N O P Q
Энергия и размер орбиталей увеличивается. Совокупность всех электронов, которые находятся на одном энергетическом уровне, - это электронный слой
На одном энергетическом уровне могут находиться орбитали, которые имеют различные геометрические формы.Формы орбиталей и облаков характеризуются побочным (орбитальным)квантовым числом - l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число l принимает значение целых чисел от 0 до n.
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются S – орбиталями (условно изображаются в виде окружности).
На K – уровне имеются только S – орбиталь.
Орбитали, для которых l = 1 , имеют форму гантели (объемной восьмерки) и называются p – орбиталями. p – орбитали имеются на всех энергетических уровнях (кроме первого – K).
Орбитали с большими значениями – l имеют более сложную форму и обозначаются так:
l = 2 d – орбитали
l = 3 f - орбитали
Орбитали одного подуровня отличаются направлением (ориентацией) в пространстве
Магнитное квантовое число m характеризует направление орбиталей в пространстве.Число значений m, определяет число орбиталей на подуровне:
S – подуровень - 1 орбиталь
p - подуровень - 2 орбиталь
d- подуровень - 3 орбиталь
f - подуровень - 4 орбиталь
Общее число орбиталей на энергетическом уровне N = n², где N - орбиталь, а n - главное квантовое число.
Электрон характеризуется еще одним спиновым квантовым числом (от латинского спин – кружить). Спиновое квантовое число – характеризует вращение электрона вокруг своей оси и принимает два значения: +½ и –½
Электроны по спинам +½ условно обозначается так: ↑, со спином –½ так: ↓.
Принцип Паули гласит: В атоме не может быть два ух электронов с одинаковым набором всех четырех квантовых чисел. Поэтому на одной орбитале не может быть больше двух электронов. Эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m) и должны отличаться спинами ↑ ↓.
Электроны ↑ или ↓ -> неспаренные.
Уч. физ.
Вопрос: Общее число электронов на энергетическом уровне N = 2n², где n – главное квантовое число. Какова формула квантования в физике?
Ответ: m · v · r = h · n
Уч. физ. Итак, мы вспомнили научные обоснования сложности строения атома. Теперь приступаем к выполнению индивидуальных практических заданий семинара.
I.(6 мин) Работа в парах по теоретическим вопросам (друг другу по 5 вопросов). Максимальная оценка 5 баллов.
1.Модели строения атома.
2.Постулаты Бора.
3.Строение атомного ядра.
4.Изотопы (примеры).
5.Радиоактивность.
6.Альфа-, бета-, гамма- излучение.
7.Ядерные силы, их особенности.
8.Характеристики нейтрона,протона,электрона.
9.Правила Содди.
10.Закон радиоактивного распада.
11.Дефект масс.
12.Энергия связи.
13.Ядерные реакции.
14.Законы сохранения и их правильное написание.
15.Применение атомной энергии.
16.Расчет энергии ядерных реакций (выделение - экзотермическая; поглощение – эндотермическая).
17.Формулы.
II.(6 мин) Индивидуально на доске все формулы по данной теме (две группы по два человека), одновременно с этим заданием взаимоопрос «Дуэль».
1. A
X
Z
t/T
2. N = N◦·2
3. ∆M = (Z·mp+N·mn﴿–Mя
4. Eсв = ∆M·c²
5. E = Ek–Ep
6. Eуд = Eсв/A
7. hν = Ek–Ep
8. 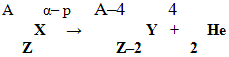
9. ν = (Ek – Ep)/h
10. 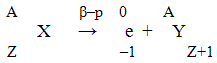
Z –1 Z+1
11. ν = R (1/n² – 1/k²﴿
12. N = 2 · n²
13. rn = r1 · n²
14. R = 3,3 · 1015 Гц
15. r = 5,3 · 10-11 м
16. m · v · r = h· n
Взаимоопрос «Дуэль»(задают вопросы друг другу).
1. Модели строения атома.
2. Ι постулат Бора.
3. ΙΙ постулат Бора.
4. Строение атомного ядра.
5. Изотопы, примеры.
6. Радиоактивность.
7. α, β, γ – излучение. Характеристики.
8. Ядерные силы, их особенности.
9. Правила Содди для α - распада, β – распада.
10. Дефект масс.
11. Энергия связи.
12. Законы сохранения для ядерных реакций.
13. Энергия выхода
14. Экзотермическая реакция.
Уч. физ. Оцените друг друга, проверьте формулы.
Уч. хим.ІІІ.(10 мин.) Работа по карточкам – заданиям. І вариант (А), ІІ вариант (Б). Тест поля А, поля Б. Отвечаем на первые пять вопросов. Проверяем по компьютеру (слайды с заданиями и ответами).
Уч. физ. Внимание!
(Работа по карточкам) По нуклонному составу, используя периодическую таблицу, назвать химический элемент.
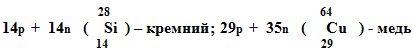
Уч. хим.
Внимание!
Назвать химический элемент по электронной конфигурации.
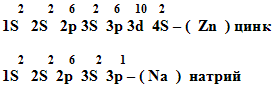
Уч. физ.
Работа на быстроту.
1. Допиши реакцию (стр. 48 №3, 4 задачн. Л. А. Кирик, достат. ур.) на доске.
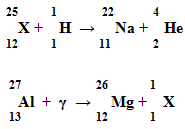
Уч. хим. 2. Распределить электроны полученных элементов по уровням.
Уч. физ. 3. Реакция деления ядер урана:
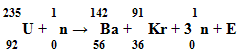
Уч. физ. 4. Записать уравнение реакции при α – распаде, β – распаде (стр. 146 № 4, 5 задачн. Л. А. Кирик, достат. ур.).
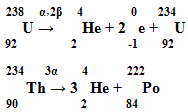
Уч. хим.(Слайды 10 - 18).Радиоактивные превращения сопровождаются образованием новых элементов и выделяется большое количество энергии. Где применяется эта энергия? (Ответ сопровождается показом слайда «Применение ядерной энергии»).
Уч. физ.
Итоги
Заполнение оценочного листа.
Подсчет баллов. Выставление оценок по баллам.
Треугольник рефлексии.
Д.з. Подготовка к контрольной работt
Заключительные слова
«Квантовая механика очень впечатляет, но внутренний голос говорит мне, что это еще не окончательная истина».
Альберт Эйнштейн.
Дополнительный материал:
1г U – урана выделяет столько энергии, сколько при сгорании 3т угля или 2,5т нефти.
Одно ядро U – урана при делении выделяет 200 MэB энергии.
Приложения
1. Презентация «Решение задач» (Приложение 2).
2. Вопросы и задания (Приложение 3).
3. Оценочный лист (Приложение 4).
4. Анимированные изображения: