Тема: "Подгруппа кислорода"
9-й класс
Структура модуля |
Количество уроков |
Форма и содержание уроков |
Вводная часть |
1 урок |
Знакомство со
структурой модуля. |
Диалогическая часть |
2 урок 3 урок 4,5 уроки |
Сера, строение молекул, физические и химические свойства. (Семинар, работа в группах) Серная кислота. (Семинар, работа в парах) Подгруппа кислорода. (Индивидуально-групповая форма работы) |
Итоговая часть |
6 урок 7 урок |
Практическая работа
№2. Тестовый контроль знаний. |
Урок №1. Общая характеристика химических элементов подгруппы кислорода. Аллотропия.
ХОД УРОКА
I. Знакомство со структурой учебного модуля.
II. Определение целей и задач.
III. Лекционное изложение материала по плану:
- Положение элементов VI А группы в периодической системе Д.И. Менделеева. Строение их атомов.
- Характеристика простых веществ. Аллотропия.
- Состав летучих водородных соединений (ЛВС), вид химической связи в них, прочность молекул.
- Состав оксидов, гидрооксидов, их характер.
По ходу изложения нового материала составляется схема - конспект.
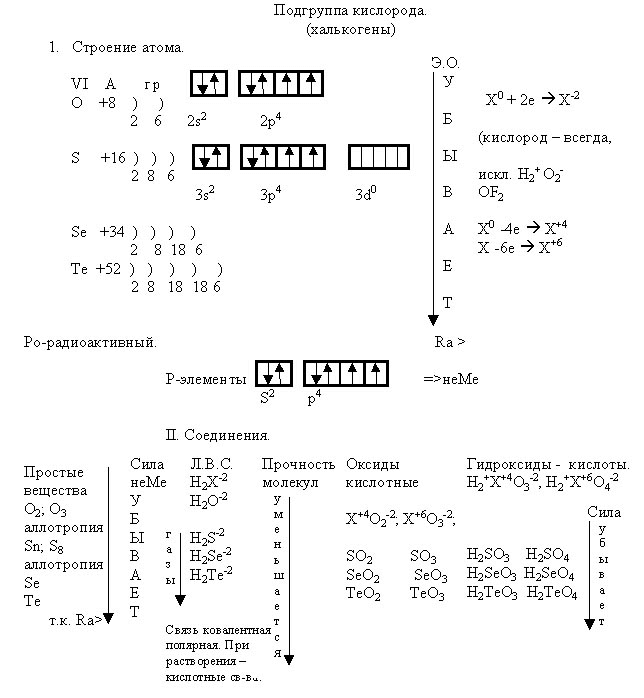
Задание: просмотреть схему-конспект, сформулировать обобщающие выводы (работа в парах).
Предполагаемый ответ: халькогены сходны по строению внешнего электронного слоя атомов, по составу и свойствам их водородных соединений, оксидов, гидрооксидов. Различаются атомными массами, зарядом ядер атомов, числом электронов, радиусом атомов. В связи с увеличением радиуса атома сверху вниз неметаллические свойства ослабевают, электроотрицательность уменьшается, изменяются и свойства соединений: уменьшается прочность молекул летучих водородных соединений, убывает сила кислот. Следовательно, свойства элементов определяется строением атомов. Свойства веществ определяются строением вещества.
Задание на дом: Опорный конспект.
Урок №2. Сера, строение молекул, физические и химические свойства.
Цель урока. Закрепить понятия “химический элемент”, “простое вещество” на примере серы. Продолжить развитие умений устанавливать причинно-следственные связи между строением и свойствами вещества, составлять уравнения реакций, отражающие свойства серы и рассматривать их с точки зрения окисления, восстановления.
Оборудование. Образцы серы и её природных соединений.
Методички с заданиями.
ХОД УРОКА
I. Знакомство с целями и задачами урока.
II. Изучение нового материала.
1. Краткая историческая справка об использовании серы человеком.
2. Работа в группах
(Группы формируются на перемене, на уроке ученики рассаживаются за столами, обозначенными литерами “А”, “Б”, “В”, “Г”, “Д”. В каждой группе назначается ведущий-координатор.)
Задание. Изучите характеристику серы по учебнику с.26-28 (Ф.Г. Фельдман, Г.Е. Рудзитис, 9 класс). Составьте опорный конспект на основе плана.
(В сильном классе учащиеся сами составляют план характеристики, его можно представить в виде кластера). [Приложение I].
При изучении статьи “Сера в природе” выполните лабораторный опыт 2 “Ознакомление с образцами серы и её природных соединений”, согласно инструкции на с. 32 учебника.
III. Защита лучших опорных конспектов у доски. (Приложение II)
(Перед защитой опорных конспектов формируется группа аналитиков, им выдается оценочный бланк).
| Стол | Состав группы | Представитель (Ф.И. ученика) | Лаконичность | Структурность | Наглядность | Автономность | Доступность | Итог |
| “А” | 1 2 |
IV. Закрепление полученных знаний.
1. Самостоятельная работа. Выполните упражнение
5 на с.29.
2. Взаимопроверка с использованием
ответов-эталонов. Взаимооценка.
(Учитывается степень участия в составлении опорного конспекта, правильность выполнения упражнения).
V. Подведение итогов работы.
Против каждого пункта в знаниях и умениях отметьте, что усвоили (“+”), что – нет (“–”), в чем сомневаетесь (“?”).
Оцените свои знания и работу на уроке:
- “Отлично”.
- “Хорошо”.
- “Удовлетворительно”.
Приложение I
Тема. СЕРА.
Кластер по теме.
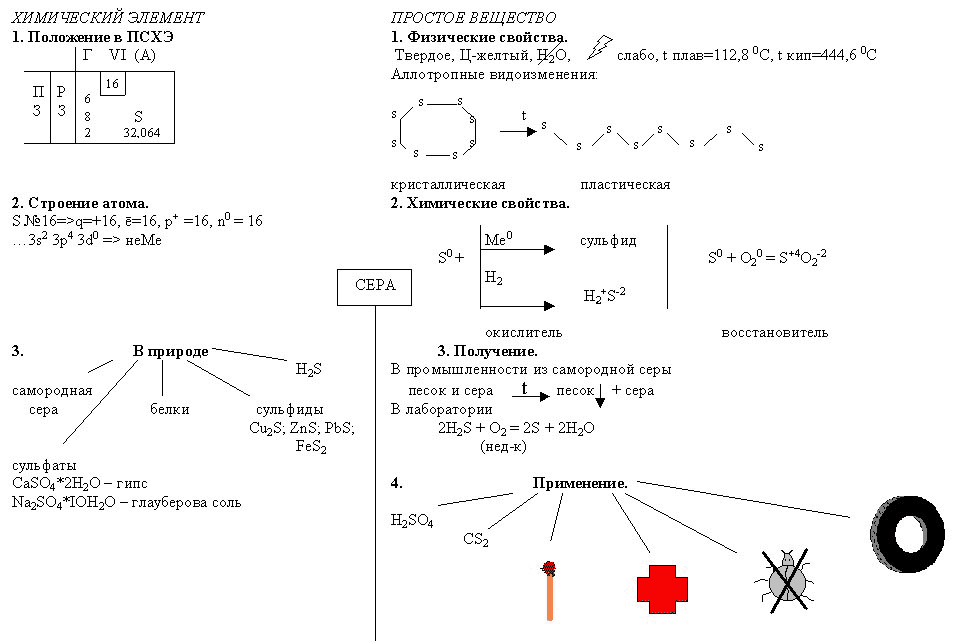
Приложение II
Тема. СЕРА.
Опорный конспект, составленный группой учащихся.
Урок №3. “Серная кислота”
Знать:
Строение и свойства серной кислоты;
Области применения;
- Качественную реакцию на сульфат-ион;
- Правила техники безопасности (ТБ) при работе с серной кислотой;
Уметь:
- Доказывать свойства серной кислоты (разбавленной и концентрированной);
- Записывать уравнения химических реакций в молекулярном, ионном виде и с точки зрения окислительно-восстановительных процессов.
Оборудование и реактивы для проведения лабораторного опыта №3: растворы сульфата натрия, сульфата цинка, разбавленный раствор серной кислоты, цинк, раствор хлорида бария.
ХОД УРОКА
I. Организационный момент.
II. Работа в парах по заданиям.
Задание1. По плану изучения темы на отдельном листе начинайте составлять конспект, используя §13 учебника (стр.29-31).
План изучения темы.
1. Состав и строение молекул серной кислоты.
А) химические формулы (молекулярная,
структурная, электронная);
Б) виды химической связи;
В) относительная молекулярная масса.
2. Физические и химические свойства серной кислоты.
А) общие с другими кислотами;
Б) специфические.
3. Способы получения.
4. Применение.
Задание 2. (Выполняется после
рассмотрения химический свойств серной кислоты
общих с другими кислотами).
Напишите молекулярные, полные и сокращённые
ионные уравнения химических реакций,
происходящих между раствором серной кислоты и
следующими веществами: оксидом алюминия,
гидрооксидом меди (||), магнием, карбонатом натрия.
Проверьте правильность выполнения работы в паре.
Для проверки используйте образцы ответов.
Задание 3. (выполняется после изучения специфических свойств серной кислоты). Концентрированная серная кислота при нагревании реагирует с ртутью и серебром, подобно тому как она реагирует с медью. Составьте уравнения этих реакций и укажите окислитель и восстановитель. 1 вариант. Взаимодействие конц.серной кислоты с ртутью. 2 вариант. Взаимодействие конц.серной кислоты с серебром. Проверьте правильность выполнения. |
Дополнительная информация. При взаимодействии конц. серной
кислоты с малоактивными металлами образуются:
сульфат, вода и оксид серы (IV); по схеме: Me+H2SO4(конц,to)--> Me2(SO4)n+H2O+S+4 или So или S-2 На холоде: пассивируются железо, алюминий, хром |
Выполните лабораторный опыт 3 “Распознавание сульфат-ионов в растворе”.(см. инструкцию на стр. 32 учебника)
Оцените правильность выполнения работы в паре.
III. Подведение итогов работы.
Озвучивание опорного конспекта.
IV. Самооценка.
Прочитайте цель урока. Достигли ли вы её ? В какой степени? Какие вопросы вызвали наибольшее затруднение? Оцените свою работу на уроке по пятибалльной системе.
Задание на дом: § 13, схема-конспект, упр.3 стр.31. письменно (если есть время можно выполнить на уроке).
Уроки № 4, 5. Тема: “Подгруппа кислорода” (семинар).
Знать:
- Положение халькогенов в П.С.;
- Строение их атомов;
- Определение аллотропии и аллотропных видоизменений;
- Свойства серы и её соединений.
Уметь:
- Составлять схемы строения атомов серы и кислорода;
- Составлять уравнения реакций, отражающие свойства серы и её оксидов;
- Составлять уравнения реакций, характеризующие свойства серной кислоты;
- Записывать уравнения реакций в молекулярном ионном и окислительно-восстановительном виде;
- Составлять план распознавания веществ;
- Определять сульфат-ион;
- Решать задачи, если одно из реагирующих веществ дано в избытке.
В процессе работы против каждого пункта в знаниях и умениях отмечайте:
Что усвоили (“+”), что – нет (“-”), в чём сомневаетесь (“…?”).
Тема |
Задания |
Рекомендации |
1. Положение элементов
подгруппы кислорода в П.С., строение их атомов. |
1. Назовите элементы подгруппы кислорода. 2. Как сказывается увеличение радиуса атома на изменении неметаллических свойств? 3. Как изменяется электроотрицательность химических элементов подгруппы кислорода? 4. На основе теории строения атомов, поясните, почему кислород является более сильным окислителем, чем сера? 5. Сравните свойства кислорода и озона, кристаллической и пластической серы. На основе этих примеров поясните сущность аллотропии. |
Устно, работа в парах
Письменно и взаимопроверка |
2. Окислительно- |
1. Какое из приведённых веществ может проявлять как окислительные, так и восстановительные свойства.
Ответ аргументируйте. 2. Запишите уравнения реакций
взаимодействия серы с |
ПОМНИ! Отдать электроны – окислиться, взять – восстановиться. |
3. Соединения серы и их свойства. |
1. Каков характер высших оксидов элементов подгруппы кислорода? 2. Как практически доказать, что водный раствор оксида серы (VI) имеет кислотный характер? 3. С какими из перечисленных веществ реагирует оксид серы (IV): вода, гидроксид кальция, хлорид натрия, оксид магния, гидроксид меди (II), оксид углерода (IV)? Запишите уравнения возможных реакций. 4. Запишите уравнения реакций следующих превращений: H2S --> SO2 --> K2SO3 --> K2SO4 5. Определите, в каких группах реакции практически осуществимы: А) Cu + H2SO4 (разб) ; KOH + H2SO4 Запишите уравнения возможных реакций, реакцию обмена в ионном виде. 6. Запишите уравнения реакций взаимодействия конц. H2SO4 с медью. Рассмотрите его с точки зрения окисления, восстановления. 7. Какие соли образует серная кислота? Условия их образования. |
Дополнительная информация. Оксид серы (IV) – бесцветный газ с резким запахом. Оксид серы (VI) – бесцветная, легко подвижная жидкость. Вспомни особенности взаимодействия сложных веществ с кислородом. Используя эталоны ответов, проверьте выполнение работы в паре. Взаимооценка. |
4. Качественные реакции. |
1. Предложите способы подтверждения качественного состава серной кислоты. 2. Составьте план распознавания веществ: хлорида натрия, сульфата натрия и хлорида меди (II). |
Взаимооценка. |
5. Рещение задач. |
Задача 1 (II уровень). Вычислите массу осадка, полученного при взаимодействии раствора, содержащего сульфат натрия массой 2,84 г с раствором, содержащим хлорид бария массой 2,08 г. Задача 2 (I уровень). Какая масса соли образуется при растворении 1,95 г. цинка в 100 г раствора серной кислоты с массовой долей 6,86%? Каковы массовые доли веществ в образовавшемся растворе? |
Реши любую задачу на выбор.
Самоконтроль. Воспользуйся образцами решения |
Подведение итогов. Самооценка.
Задание на дом. Подготовиться к итоговому контролю знаний