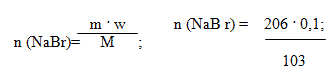Тип урока: урок изучения нового материала.
Цели урока:
- Дать общую сравнительную характеристику галогенов в свете трёх форм существования элементов: свободных атомов, простых веществ и их соединений. На материале химии галогенов закрепить и систематизировать химические понятия такие как «химическая связь», «кристаллические решётки», «окисление и восстановление».
- Способствовать развитию творческого мышления у учащихся, умения устанавливать взаимосвязь между знаниями, обобщать и делать выводы.
- Формировать умение коллективно работать, анализировать и делать выводы.
Оборудование:
- Периодическая таблица химических элементов Д.И.Менделеева, учебник «Химия» 9 класс, компьютер, проектор.
- Приборы и реактивы: фарфоровые пестик и ступка, кристаллики иода, металлический натрий.
Методы:
- Словесный.
- Практический.
- Наглядный.
- Проблемный.
Формы обучения:
- Коллективные (фронтальные).
- Индивидуальные.
- Групповые (микрогруппы).
План урока:
- Постановка основных задач урока.
- Постановка проблемы (сравнительная характеристика атомов галогенов по их положению в периодической системе элементов).
- Строение простых веществ-галогенов (тип химической связи, тип кристаллической решётки).
- Предполагаемые физические и химические свойства галогенов.
- Постановка проблемы( химические свойства галогенов с точки зрения окислительно-восстановительной двойственности)
- Демонстрационный эксперимент: взаимодействие иода с натрием.
- Видеодемонстрация: «Горение железа в хлоре»
- Выполнение заданий на закрепление знаний о взаимодействии галогенов с простыми веществами.
- Изменение окислительной способности галогенов.
- Закрепление изученного материала (решение расчётной задачи)
ХОД УРОКА
I. Организация начала урока
Учитель ставит перед учащимися основные задачи урока:
- сравнить атомы галогенов по их положению в ПСХЭ и строению атомов;
- рассмотреть строение молекул, физические и химические свойства галогенов – простых веществ.
II. Изучение нового материала
1. Определите положение галогенов в периодической системе элементов Д.И.Менделеева. Сравните изменения в строении атомов галогенов в группе сверху вниз.
Учащиеся самостоятельно определяют место
положение галогенов в Периодической системе
химических элементов, указывают, что в атомах
этих элементов на внешнем энергетическом уровне
расположены 7 электронов им недостаёт одного
электрона, поэтому галогены проявляют
окислительные свойства.
Далее учащиеся рассматривают закономерность
изменения окислительных свойств,
электроотрицательности в связи с увеличением
радиуса атома.
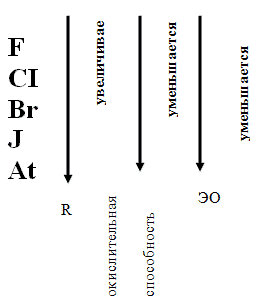
Учащиеся называют возможные степени окисления галогенов: – 1, 0, +1, +3, +5, +7.
Только атом F, как наиболее электроотрицательный элемент проявляет постоянную степень окисления в соединениях – 1.
2. Рассмотрите электронное строение молекулы галогена на примере молекулы хлора. Определите тип химической связи и тип кристаллической решётки
Учащиеся составляют схему электронного строения молекулы хлора и отвечают на поставленные вопросы.
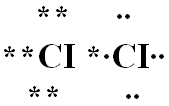
Учащиеся делают следующие выводы:
- молекулы галогенов двухатомные;
- атомы в молекулах связанные ковалентной неполярной связью;
- галогены имеют молекулярную кристаллическую решётку.
3. На основании типа химической связи и типа кристаллической решётки предположите физические свойства галогенов.
Учащиеся предполагают, что галогены – это
вещества газообразные с низкой температурой
кипения.
Учитель: Уточните, выдвинутые вами
предположения, воспользовавшись материалом
учебника стр. 105 таблица №7. (Габриелян О.С.
Химия 9 класс – М.: Дрофа, 2011)
Учащиеся делают общие выводы:
- с увеличением молекулярной массы галогенов повышается температура плавления и температура кипения.
С увеличением размеров атомов и молекул галогенов возрастает и сила межмолекулярного взаимодействия между ними:
- возрастают плотности: бром – жидкость, иод – твёрдое вещество, хлор и фтор – газы;
- от F2 к J2 усиливается интенсивность окраски.
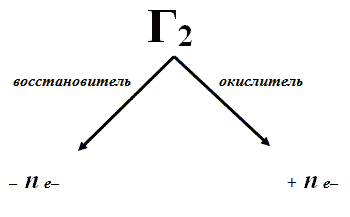
4. Предположите возможные химические свойства галогенов – простых веществ. Обоснуйте свои предположения (работа в парах)
Учащиеся предполагают, что галогены как простые вещества имеют промежуточную степень окисления равную 0, поэтому галогены проявляют окислительно-восстановительную двойственность.
5. Д/О: «Взаимодействие йода с натрием»
В фарфоровую ступку поместили несколько
кристалликов иода, которые втираются
пестиком во внутреннюю поверхность стенки
ступки. Затем в неё поместили кусочек натрия,
который растирается на поверхности
ступки. Из-под пестика раздались звуки взрыва,
появилось пламя и фиолетовые пары иода.
0 0 +1 –1
2Na + J2 = 2NaJ
6. Видеодемонстрация: «Горение железа в хлоре»
7. Задание: закончить уравнения реакций:
- Al + J2 =
- Al + Br2 =
- Sb + CI2 =
- Fe + CI2 =
8. Изменение окислительной способности галогенов
Учитель напоминает учащимся, что при реакциях с
металлами побочных подгрупп с галогенами
образуются галогениды с большей степенью
окисления металла.
Окислительная способность галогенов
уменьшается в ряду: F2 Cl2
Br2 J2
Ослабление окислительных свойств галогенов
проявляется при взаимодействии с водородом:
Н2 + Г2 = 2НГ
Уменьшение окислительных и увеличение
восстановительных свойств галогенов от фтора к
иоду
наблюдается в их способности вытеснять друг
друга. Так хлор вытесняет бром и иод из растворов
их солей:
Cl2 + 2NaBr = 2NaCl + Br2
Br2 + 2 NaJ = 2NaBr + J2
Для фтора эта реакция не характерна, так как она протекает в растворе, а фтор взаимодействует с водой, вытесняя из неё кислород:
F2 + 2H2O = 4HF + O2
При взаимодействии с водой хлора, последний проявляет окислительно-восстановительную двойственность:
0 –1 +1
Cl2 + H2O = HCl + HClO
III. Закрепление изученного материала:
Определите объём хлора, необходимого для вытеснения брома из 206г 10%-ного раствора бромида натрия.
Решение:
Cl2 + 2NaBr = 2NaCI + Br2
n (NaBr) = 0,2 моль.; n(Cl2) = 1/2 n(NaBr) = 0,1моль.V(Cl2) = 0,1 моль . 22,4 л/моль = 2,24л.
Ответ: объём хлора 2,24л
Домашнее задание:
стр. 104-109
стр.110 №5