Задачи урока.
- Обучающие:
- изучение электронного строения атома углерода, знакомство с общей его характеристикой;
- изучение основных физических и химических свойств кислородных соединений углерода;
- знакомство с важнейшими соединениями углерода (II) и (IV), качественной реакцией на карбонат-ион.
- Развивающие:
- развитие умения работать с химическими веществами, с текстом учебника;
- развитие химического мышления, развитие умения делать выводы.
- Воспитательные:
- развитие оммуникативных умения в ходе парной и коллективной работы;
- формирование понимания необходимости привлечения средств химии к объяснению процессов, происходящих в окружающем мире.
Оборудование: карбонат кальция, р-р. HCI, пробирки, лакмус.
Тип урока: изучение нового материала
Средства обучения: учебник, таблицы, коллекция минералов химические вещества, мультимедиа.
ХОД УРОКА
I. Строение атома
Определите положение углерода в ПСХЭ.
Углерод – элемент IV группы, главной подгруппы.
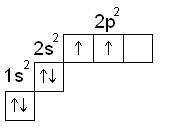
Электронная формула: +12 С 1s22s22p2
1. Нормальное состояние атома углерода
В нормальном состоянии атом углерода имеет степень окисления +2.
В данной степени окисления углерод образует оксид – СО
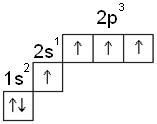
2. Возбужденное состояние атома углерода
В возбужденном состоянии атом углерода
имеет степень окисления +4.
В данной степени окисления углерод образует
оксид – СО2
II. Физические свойства. Работа с учебником
Используйте учебник с.172-173, заполните таблицу
Сравнительная характеристика оксидов углерода (II) и (IV)
Свойства |
Оксид углерода(II) |
Оксид углерода (IV) |
| Агрегатное состояние | газ | газ |
| Молекулярная масса | 28 г/моль | 44 г/моль |
| Строение молекулы | :С=О: слабо-полярная |
О=С=О неполярная |
| Цвет | бесцветный | бесцветный |
| Запах | нет запаха | нет запаха |
| Растворимость | малорастворимый | хорошо растворимый |
| Физиологическое действие | ядовит, попадая в кровь, соединяется с гемоглобином, препятствует переносу кислорода. | накапливаясь в организме, вызывает возбуждение дыхательного центра, возникает асфиксия. |
Проверка таблицы
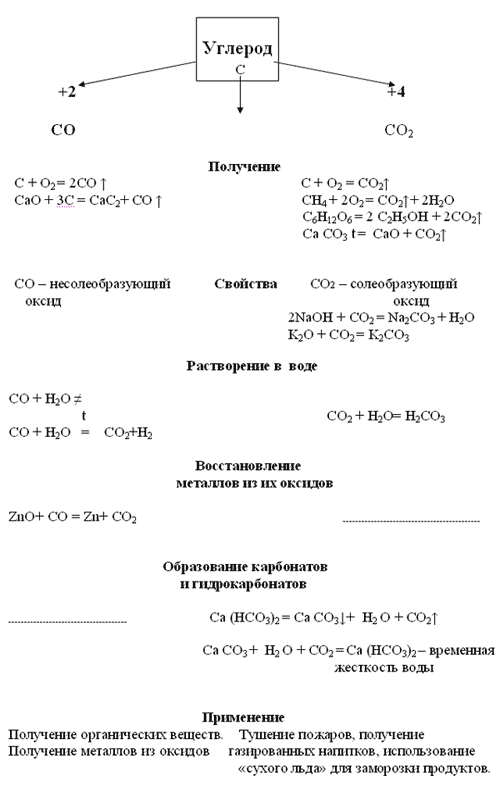
III. Химические свойства. Составление опорного конспекта.
IV. Кислородные соединения углерода. Изучение коллекции минералов.
Кислородные соединения углерода в природе встречается в виде карбонатов:
| Соединения: мел, известняк, мрамор (все
соединения имеют в своем составе – карбонат
кальция CaCO3) Коллекция минералов |
Рассмотреть образцы соединений углерода, отметить основные его характеристики.
V. Качественные реакции на карбонат-ион (CO32–)
Качественные реакции – реакции, с помощью
которых распознаются различные вещества.
Качественные реакции, как правило, протекают с
каким-либо ярким внешним эффектом.
Карбонаты и гидрокарбонаты можно обнаружить с
помощью растворов кислот: при действии на них
кислот наблюдается характерное «вскипание»
из-за выделяющегося углекислого газа. Эта
реакция является качественной реакцией на соли
угольной кислоты.
Лабораторный опыт. Получение оксида углерода (IV), качественная реакция на карбонат – ион (CO32–)
В пробирку помещаем несколько кусочков мела
или мрамора и приливаем 2-3 мл. разбавленной
соляной кислоты. Закрываем пробирку пробкой с
газоотводной трубкой. Конец трубки опускаем в
другую пробирку, в которой находится 2-3 мл.
известковой воды.
Записать уравнения возможных реакций и
представить их в ионном виде:
CaCO3 + 2HCl = CaCl2 + CO2
+ H2O
Ca2+ + CO32– +2H+ + 2Cl– = Ca2+ + 2Cl– + CO2+ H2O
CO32– + 2H+ = CO2+ H2O
CO2 + Ca(OH)2 = CaCO3+ H2O
Помутнение известковой воды дает основание, что в данном растворе образовался карбонат кальция, дальнейшее пропускание углекислого газа ведет к получению растворимого гидрокарбоната – Ca (HCO3)2
CaCO3
+ H2O + CO2 = Ca(HCO3)2
VI. Закрепление материала
Генетические ряды C+2, C+4. (работа в парах)
1) C––> CO ––> CO2––> H2CO3
2) C2H2 ––> CO2 ––> CaCO3––> CO2
Проверка у доски.
VII. Домашнее задание
Параграф 30 (Кислородные соединения углерода) по учебнику О.С. Габриеляна «Химия 9класс»; выполнить упражнения 6.7 с.178 учебника.
VIII. Итоги урока
Учитель подводит итог урока, объявляет оценки за урок, отмечает активных учащихся на уроке.
IX. Литература
1. О.С. Габриелян. Химия. Учебник. 9 класс. –
М., Дрофа, 2006.
2. О.С. Габриелян, И.Г. Остроумов.
Настольная книга учителя. Химия. 9 класс. – М.,
Дрофа, 2006.