Тип урока: урок закрепления изученного материала.
Вид урока: сюжетно-ролевой с элементами драматизации.
Цель урока:
- 1. Повторить свойства кислорода, состав оксидов.
- 2. Показать значение кислорода в природе и жизни человека.
Задачи урока:
- Представить кислород в виде “одушевленного” персонажа и провести поэтапное “расследование” его свойств.
- Акцентировать внимание учащихся на связь исторических событий, биохимических свойств, раскрывающих возможности и значение кислорода.
- Развивать и укреплять у учащихся навыки химического эксперимента.
- Способствовать развитию у учащихся логики, сообразительности, находчивости, а также актерских и других способностей, через которые пробудить интерес к химии.
- Воспитывать у учащихся бережное отношение к окружающей среде.
- Воспитывать у учащихся культуру речи, поведения.
Оборудование и реактивы: раствор перекиси водорода, MnO2, лучинка, спички, паспорт кислорода, к/ф “Кислород”, набор слайдов, карточки с заданиями.
Ход урока
Учитель: Здравствуйте, ребята. Садитесь. На этом уроке мы поговорим об очень важном для жизни на нашей планете химическом элементе и его соединениях. А что это за элемент вы поймете, посмотрев маленькую сценку “Странная болезнь мистера Х”.
Раздается стук, входит мистер Х и подходит к доктору Ватсону и Шерлоку Холмсу.
Мистер Х: Уважаемый мистер Холмс, я много о Вас слышал и решил, что только Вы сможете мне помочь в этой ситуации.
Холмс: Я Вас внимательно слушаю.
Мистер Х: Видите ли, мистер Холмс, десять дней назад, проснувшись утром, я обнаружил, что не знаю, кто я. Это просто ужасно! Я не в состоянии что-либо вспомнить о себе, и от этого пребываю в отчаянии! Умоляю, сэр, помогите мне, пожалуйста!
Холмс: Успокойтесь. Мне кажется, что Вам будет полезно познакомиться с моим другом, доктором Ватсоном.
Ватсон, по-моему, то, что случилось с мистером, больше по вашей врачебной части, это болезнь, которая называется амнезией, она проявляется потерей памяти.
Ватсон: О. сэр, от Вас веет таким холодом! Ваша температура ниже минус 219 градусов. Вы представляете собою холодный синий лед. Присаживайтесь, у нас здесь тепло, Вы сейчас согреетесь.
Мистер Х: Я чувствую, как у меня повышается температура, и превращаюсь в голубую жидкость (из синих варежек течет голубая жидкость). Мне становиться жарко.
Ватсон: Ваша температура ещё повысилась, и Вы превратились в бесцветный газ. (Мистер Х снимает синюю шапочку, синие очки и синие перчатки). Вам лучше?
Мистер Х: Я чувствую, что ко мне начинает возвращаться память.
Холмс: Чтобы Вам помочь, мы спросим о Вас у историков.
1-ый историк: Человечеству Вы известны с начала XVII века. Вас открыл изобретатель подводных лодок Дреббел. Но результаты его были засекречены из-за военной направленности, а поэтому они не были известны современникам.
2-ой историк: В 1750 году М. В. Ломоносов доказал, что Вы входите в состав воздуха.
3-й историк: Вас, независимо друг от друга, открыли одновременно два известных химика XVIII века – англичанин Джозеф Пристли и швед Карл Шееле. А имя Вам дал французский ученый Антуан Лавуазье.
Холмс: Спасибо. Дальше нам необходимо поговорить с биологами.
1-й биолог: Ваше имя хорошо известно всем жителям нашей планеты. Вы самый распространенный на Земле элемент. Без пищи и воды люди могут прожить несколько суток, а без Вас – несколько минут.
2-й биолог: В сутки через легкие человека проходит Вас приблизительно 800 литров. Но, к сожалению, за последние 100 лет Вас уничтожено 240 млрд. тонн и выброшено взамен 360 млрд. тонн углекислого газа. Конечно, Ваше содержание еще велико, но все же стоит задуматься над этим жителям нашей планеты уже сейчас.
Член химического кружка:
Если развитие человеческого общества не пойдет по другому пути, то, по прогнозам экологов, в середине XXI века произойдет экологический взрыв: будут отравлены вода, воздух, земля и растения. Это приведет к вырождению животных, а в конечном итоге и человека.
Наиболее грозный предвестник возможной катастрофы – изменение состава атмосферы. Причем на изменение ее состава влияют выброс ядовитых веществ в результате отсутствия или неэффективной работы очистительных сооружений промышленных предприятий, использование человеком различного вида транспорта с двигателем внутреннего сгорания, реактивным двигателем; изменяют ее состав, к сожалению, не в лучшую сторону и другие “продукты” цивилизации.
Например, автомобильный транспорт является одним из наиболее мощных загрязнителей атмосферы. В выхлопных газах двигателей содержатся оксиды углерода, азота, серы, продукты неполного сгорания бензина.
Членами нашего химического кружка было установлено, что в течение часа мимо нашей школы проезжает около 320 автомобилей в летнее время и около 260 автомобилей в зимнее. В то время как санитарные требования по уровню загрязнения допускают поток автотранспорта в жилой зоне интенсивностью не более 200 автомобилей в час. Напрашивается вывод о регулировании (сокращении) потока автомобилей. Однако только одними запретительными мерами проблему не решишь. Нужны более эффективные и цивилизованные методы. Например, необходимо автотранспорт переводить на экологически чистое топливо. А это задача ближайшего будущего, т. е. наша и ваша.
3-й биолог: Главные Ваши поставщики в атмосферу – морские водоросли, растения, которые выделяют Вас в результате процесса фотосинтеза.
4-й биолог: Вы, как химический элемент, образуете еще одно вещество – озон, который образует озоновый слой на высоте 15 – 30 км, защищающий нашу планету от губительного ультрафиолетового излучения.
Небольшое количество озона образуется при работе ксерокса. В малых концентрациях озон благоприятно действует на организм человека, создавая ощущение свежести. При больших концентрациях его в воздухе он раздражает дыхательные пути, вызывает кашель и головокружение.
Озон убивает микроорганизмы, поэтому его используют для дезинфекции помещений и на водоочистительных станциях.
Холмс: Сэр, Вы довольны своей ролью и значением? А чтобы Вы узнали свое полное имя, мы обратимся к химикам.
Химик: Уважаемый сэр! Разрешите мне проделать опыт по Вашему получению и доказать Ваше присутствие (получает кислород из перекиси водорода) Ваше имя – кислород.
2-й химик: Вы отличаетесь высокой химической активностью, взаимодействуете с большинством элементов, кроме золота, платины, криптона, ксенона, галогенов. А также вступаете в реакции со сложными веществами. В результате этих реакций образуются оксиды.
3-й химик: У нас есть видео кадры, показывающие как еще можно получить кислород и его взаимодействие с простыми веществами (просмотр к/ф).
Холмс: Уважаемый сэр, нами установлено Ваше имя – кислород, по научному – оксигениум. Мы вручаем Вам “паспорт” с подробными данными, чтобы Вы не забывали свое имя. В нем записано, что вы элемент 2 малого периода 6 группы, главной подгруппы периодической системы Д.И. Менделеева, химический знак – О, порядковый номер – 8, относительная атомная масса – 16, неметалл, в соединениях проявляете валентность – II. (Вручает кислороду его паспорт).
(Ученик читает стихотворение на фоне слайдов):
Из атомов мир создавала Природа,
Два атома легких взяла водорода,
Прибавила атом один кислорода
И получилась частица воды,
Море воды, океаны и льды…Стал кислород чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.И на Земле появились растения,
Жизнь появилась: дыханье, горение…
Первые птицы и первые звери,
Первые люди, что жили в пещере…Огонь добывали при помощи трения,
Хотя и не знали причины горения…
Роль Кислорода на нашей Земле
Понял великий Лавуазье.
Учитель: По высказыванию Берцелиуса “ Кислород – это вещество, вокруг которого вращается земная химия”. Сейчас мы проверим, а что вы знаете о нем:
1. Перед Вами на доске уравнения получения кислорода:
а) 2Н2О2 –> 2Н2О + О2;
б) КМпО4 –> К2МпО4 + МпО2 +
О2;
в) 2КNO3 –> 2KNO2 + O2.
В каком из них неправильно расставлены коэффициенты?
Какое условие необходимо для того, чтобы реакция с перекисью водорода протекала быстрее?
Какие вещества называются катализаторами?
Из какого вещества вы на практическом занятии получали кислород?
2. Дана реакция в общем виде:
4А + 5О2 = 2А2О5.
Какое вещество может сгорать по такой схеме?
а) Сера; б) Алюминий; в) Калий; г) Фосфор.
3. Вы смотрели кадры взаимодействия кислорода с серой и фосфором. Давайте напишем эти уравнения реакций. (На доске записыватся уравнения реакций).
Как называются образовавшиеся вещества?
Что называется оксидами?
4. Перед Вами на столах лежат листочки химического тренажёра. <Таблица1>. Работаем с I и II вариантами. Отвечаем на 1, 2 и 3 вопросы для первых пяти оксидов.
Таблица 1
Оксиды
Варианты № п/п |
I вариант |
II вариант |
III вариант |
IV вариант |
1 |
Na2O |
Ag2O |
Cr2O3 |
N2O3 |
2 |
NO |
CaO |
Li2O |
SnO |
3 |
CO2 |
N2O5 |
Fe2O3 |
CO |
4 |
PbO2 |
Cu2O |
CI2O7 |
CaO |
5 |
BaO |
SO3 |
FeO |
N2O |
6 |
P2O3 |
ZnO |
CI2O |
P2O5 |
7 |
N2O3 |
CuO |
SiO2 |
SnO2 |
8 |
Mn2O7 |
NO2 |
CrO3 |
AI2O3 |
9 |
PbO |
SO2 |
P2O5 |
CO2 |
10 |
SeO3 |
SO3 |
MgO |
NO |
Задания:
- Определите валентность элементов, образующих оксиды.
- Определите, какие из оксидов вашего варианта образованы элементами-металлами (элементами-неметаллами).
- Назовите оксиды вашего варианта.
- Выберите и назовите формулы кислотных (основных) оксидов.
- Выберите формулы оксидов металлов, проявляющих валентность от одного до трёх. Составьте уравнения реакции получения этих оксидов.
- Выберите формулы оксидов, способных вступать во взаимодействие с водой с образованием солей. Дайте им названия.
- Какие из оксидов вашего варианта способны вступать во взаимодействие с раствором серной кислоты (соляной кислоты, гидроксида натрия)? Составьте уравнения соответствующих химических реакций.
- Составьте уравнения реакций получения оснований из оксидов вашего варианта.
- Выберите формулы амфотерных оксидов, назовите их.
- Составьте уравнения реакций амфотерных оксидов вашего варианта с растворами гидроксида калия и соляной кислоты.
5. Игра: “Меткий стрелок”. (На доске написаны формулы)
Выпишите формулы веществ, которые попадут в цель. Назовите их: <Рисунок 1>
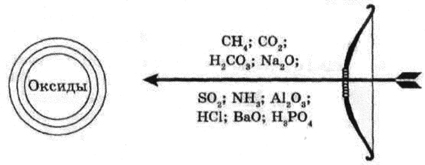
Рисунок 1
6. Поймайте “химических рыбок” на “крючок валентности”, используя формулы кислородных соединений: <Рисунок2>
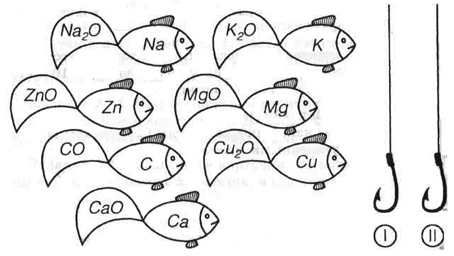
Рисунок 2
7. Игра: “Пятый лишний”.
Докажите, что выбранный вами “лишний” оксид отличается от четырех других:
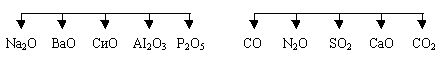
8. Задача: “Быстрый счет”.
Сколько молекул СО2 содержится в 1 моль?
Сколько атомов кислорода содержится в 1 моль СО2?
Какой объём займут 0,1 моль кислорода?
Общее число молекул кислорода: 12 ? 1026. Определить:
а) количество кислорода;
б) массу кислорода;
в) объём кислорода.
9. Игра: “Телеграмма “Что это было?”.
К нам поступила телеграмма: “Пропали вещества, вместо них появились многоточия”. Текст этой телеграммы перед Вами. Напишите пропавшие вещества и расставьте коэффициенты. Делая выбор помните: задание А – 3 балла, Б – 4 балла, С – 5 баллов.
А) I вариант |
II вариант |
Мg + ..… = МgО |
..... + О2 = СаО |
Н2 +….. = Н2О |
S + .…. = SO2 |
….. + О2 = СО2 |
Na + .…. = Na2O |
Zп + ….. = ZпО |
N2 + .…. = NО |
Б)

C) I вариант
Напишите уравнения реакций горения в кислороде: а) серы; б) алюминия; в) сероводорода Н2S.
II вариант
Напишите уравнения реакций горения в кислороде: а) магния; б) фосфора; в) этилена С2Н4.
10. На столах у вас находится таблица с данными по растворимости кислорода в воде при нормальном давлении и различных температурах. <Таблица2>
Таблица2
Температура, С0 |
0 |
10 |
15 |
20 |
25 |
30 |
100 |
Растворимость (объёмы О2 на 100 объёмов воды) |
4,9 |
3,8 |
3,4 |
3,8 |
2,8 |
2,6 |
1,7 |
Работая с таблицей, определите, где больше численность рыб: в северных или южных морях и почему?
а) В северных;
б) В южных;
в) Одинаковая.
11. При длительной работе ксерокса в помещении стал ощущаться запах озона. Что необходимо при этом сделать:
а) Прекратить работу до следующего утра;
б) Проветрить помещение;
в) Продолжать работать дальше.
Холмс: Юные джентльмены, члены клуба “Юный химик”, что Вы можете сказать о нашем госте, что Вы поняли из сегодняшнего урока?
1-й джентльмен:
Он – самый главный элемент
И нет других тут мнений:
Очень уж велик процент
Его соединений.
2-й джентльмен:
Он – кислород, да и озон,
Входит в состав растений,
Он есть и в воздухе, и в нас,
Везде – его владенья.
Учитель: Вот и подходит к концу наш урок, и я уверена в том, что Вы обогатили свои знания о свойствах кислорода. На последующих уроках мы продолжим знакомство с его соединениями. Домашнее задание.
Список использованной литературы.
- Брейгер Л.М. Нестандартные уроки. Химия. Волгоград Учитель, 2002.
- Ерёмин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В. Химия 9 класс М. Оникс 21 век , 2005.
- Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии М. Школьная Пресса. 2002.
- Оржековский П.А., Мещерякова Л.М., Понтак Л.С. Химия 8 класс М. Астрель, 2006.
- Сгибнева Е.П., Скачков А.В. Современные открытые уроки химии 8 – 9 классы. Ростов-на-Дону Феникс, 2002.
- Титова И.М. Малый химический тренажёр М. Вентана-Граф, 2001.