ТИП УРОКА: объяснение нового материала.
ЦЕЛИ И ЗАДАЧИ: расширить знания о химических свойствах солей; продолжить отработку метода практического и теоретического анализа веществ и процессов; дать понятие “гидролиз солей”; познакомить со случаями гидролиза, научить составлять его схемы; развивать у учащихся умение делать выводы на основе наблюдений и предсказывать результаты работы на основе теоретических знаний.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: видеофрагмент “Гидролиз сульфата алюминия”, проектор, компьютер, экран, 3 стакана с растворами солей: NaCl, Na2CO3, AlCl3, лакмус, стакан с твердой солью (NH4)2CO3, вода, стеклянная палочка.
РАЗДАТОЧНЫЙ МАТЕРИАЛ: набор таблиц, микролаборатория, индикаторная бумага, отпечатанные тексты: “Планы урока”, “Правила гидролиза”, “Задания к уроку “Гидролиз солей”.
ХОД УРОКА
УЧИТЕЛЬ: Сегодня мы продолжаем знакомиться со свойствами солей. На уроке “Гидролиз солей” мы работаем по планам, которые лежат у вас на столах. На экране проецирую слайд “План урока”. (Приложение 1) и читаю его.
1. ВВОДНАЯ БЕСЕДА
- Что представляют из себя соли по составу?
- Как они классифицируются?
- Приведите примеры:
а) двух средних солей, назовите их, составьте
диссоциацию солей;
б) двух кислых солей, дайте им названия, составить
уравнения диссоциации этих солей;
в) основные соли – пример, название, диссоциация.
4. Какие общие свойства солей вам уже известны?
И сейчас мы узнаем еще одно свойство этих веществ.
“Гидролиз солей” – запись темы в тетрадь
УЧИТЕЛЬ: С понятием “гидролиз” мы знакомы из курса биологии. Что оно означает и какое имеет значение?
УЧЕНИКИ отвечают на этот вопрос, приводя примеры гидролиза жиров, белков, углеводов и рассказывают о значении реакции гидролиза этих соединений.
УЧИТЕЛЬ : Вот и соли не просто растворяются и диссоциируют на ионы в воде, но и некоторые из них реагируют с ней. Это явление было обнаружено практически. Мы сейчас проведем эксперимент и убедимся в этом.
2. ЛАБОРАТОРНЫЙ ОПЫТ
Ученик читает задание лабораторной работы, которое проецирую на экране
(Приложение 2).
УЧИТЕЛЬ: Несмотря на то, что опыт несложный, об элементарных правилах техники безопасности мы должны помнить. Работая с микрометодом, какие правила мы должны соблюдать?
Вопросы после проведения опыта:
- Действуют ли растворы солей на индикаторы?
- Как действуют?
- Какую среду показывают индикаторы?
- А раз изменился цвет, что мы можем сказать об этом процессе?
- Идет ли реакция с H2O у некоторых солей?
- К какому типу относится эта реакция?
3. ПОНЯТИЕ “ГИДРОЛИЗ СОЛЕЙ”
Даю определение реакции.
Гидролиз соли – процесс взаимодействия ионов соли с молекулами воды, в результате которого образуются слабо диссоциирующие молекулы или ионы.
УЧИТЕЛЬ: Почему в растворах солей образовалась разная среда? Для этого вспомним, чем обусловлена кислая среда в кислотах? Щелочная среда в растворах щелочей? А в солях общих ионов нет. Они разные по составу. Поэтому и результат гидролиза разный.
4. ВИДЫ ГИДРОЛИЗА СОЛЕЙ.
УЧИТЕЛЬ: Все соли по составу можно разделить на 4 группы, результат гидролиза будет зависеть от этого состава.
Мы знаем, что соли образуются в результате реакции обмена, между кислотой и основанием. И вот в зависимости от того, какая по силе кислота и основание ее образование зависит от рН среды.
Рассмотрим 4 случая и составим схемы.
В тетрадь: Схемы гидролиза солей
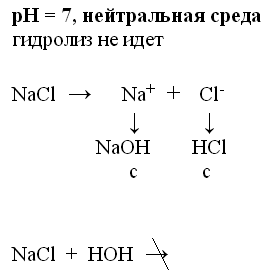
1. Соль образована сильным основание и сильной кислотой.
(какая это соль в нашем эксперименте, какой результат?)
Демонстрирую этот опыт. После реакции перед стаканом с раствором соли ставлю табличку: среда нейтральная.(Значит на стакане приклеена этикетка с формулой соли).
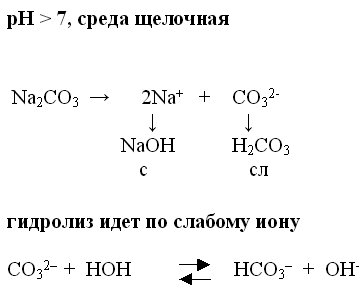
2. Соль образована сильным основанием и слабой кислотой.
(Какая это соль и какой результат?)
Демонстрирую этот опыт. После реакции перед стаканом с раствором соли ставлю табличку: среда щелочная.(Значит на стакане приклеена этикетка с формулой соли).
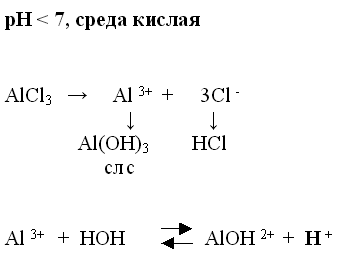
3. Соль образована слабым основанием и сильной кислотой.
Демонстрирую этот опыт. После реакции перед стаканом с раствором соли ставлю табличку: среда кислая.(Значит на стакане приклеена этикетка с формулой соли).
УЧИТЕЛЬ: А какой вариант состава соли мы не рассмотрели?
Приведите примеры таких солей.
4. Соль образована слабым основанием и слабой кислотой.
Демонстрирую опыт взаимодействия карботата аммония с водой. Учащиеся отмечают признаки реакции, идущей до конца: это появление запаха и выделение пузырьков газа.
Вызываю учащегося составить на доске уравнения данной реакции.
(NH4)2 СO3 + H2O > CO2 + 2NH3 · H2O
Реакция идет до конца.
УЧИТЕЛЬ: Посмотрите в таблицу растворимости. Какой знак стоит напротив этих солей. Что он означает?
А теперь такой вопрос:
Подвергается ли гидролизу соль Al 2 (SO4)3 ? Почему? Какая среда в растворе этой соли? По какому иону идет гидролиз?
Смотрим фрагмент
“ГИДРОЛИЗ СУЛЬФАТА АЛЮМИНИЯ”
Сравниваем предположения учащихся с просмотренным видеофрагментом. Теперь выработаем правила гидролиза.
Учитель задает учащимся вопросы:
1. С точки зрения обратимости какой это процесс – гидролиз?
2. По какому иону протекает гидролиз?
Далее учитель говорит, что гидролиз солей это слабая реакция и протекает, как правило, по I ступени.
Демонстрирую на экране слайд “Правила гидролиза”. (Приложение 3).
Закрепляем данный материал, выполняя задания по “гидролизу солей” из вариантов ЕГЭ.
I Вариант.
Задание 1.
Кислую среду имеет раствор:
1) ZnCl2; 2) Na2S; 3) СaCl2; 4) Na2SiO3.
Задание 2.
Установить соответствие между названием соли и типом гидролиза её в водном растворе
Название соли |
Тип гидролиза |
| 1) Нитрат меди (II) | А) по катиону |
| 2) Карбонат аммония | Б) по аниону |
| 3) Хлорид железа (II) | В) по катиону и аниону |
| 4) Силикат калия |
1 |
2 |
3 |
4 |
II Вариант.
Задание 1.
Фенолфталеин становится малиновым в растворе:
1) Хлорида натрия; 2) Сульфата алюминия;
3) Силиката натрия; 4) Хлорида железа (III).
Задание 2.
Установить соответствие между составом соли и типом её гидролиза
Состав соли |
Тип гидролиза |
| А) BeSO4 | 1)по катиону |
| Б) KNO2 | 2)по аниону |
| В)Pb(NO3)2 | 3)по катиону и аниону |
| Г)CuCl2 |
А |
Б |
В |
Г |
Выполнение заданий можно проверить у учащихся активно работающих на уроке. После этого объявить оценки и дать домашнее задание. При подведении итога урока еще раз следует сказать о значении гидролиза солей в технике и быту.