Цель урока: ввести понятие о солях, дать определение, познакомить с важнейшими неорганическими солями; рассмотреть состав, названия, номенклатуру, классификацию, физические свойства и составление структурных формул солей.
ХОД УРОКА
1. Проверка домашнего задания
На доске записать формулы неорганических соединений: H2SO4, K2O, Ca(OH)2, HCl, Cu(OH)2, Al2O3, HNO3, Na2O, СuO, HF, CO2, KOH, K2O, N2O5, H3PO4, Fe(OH)2, Al(OH)3, NaOH, Ba(OH)2, NaCl, Na2SO4, Ca(NaO3)2, K3PO4.
2. Фронтальная беседа
1. Какие классы неорганических соединений вы
знаете?
2. Какие соединения называют оксидами?
3. Подчеркните, синим мелом формулы оксидов и
дайте им названия.
4. Как классифицируют оксиды?
5. Назовите основные оксиды, кислотные оксиды.
6. Какие соединения называют основаниями?
7. Подчеркните желтым мелом формулы оснований и
назовите эти вещества.
8. Как классифицируют эти основания?
9. Пользуясь таблицей растворимости, выберите из
данных формул формулы растворимых и
нерастворимых оснований.
10. Какие соединения называют кислотами.
11. Как классифицируют кислоты.
12. Назовите следующие кислоты и напишите их
структурные формулы: HF, H3PO4, H2SO4.
13. Составьте молекулярные и структурные формулы
следующих оснований: а) гидрооксид натрия; б)
гидрооксид бария.
14. Напишите молекулярные и структурные формулы
оксидов элементов третьего периода.
15. Подчеркните красным мелом формулы кислот и
назовите эти вещества.
3. Изучение нового материала
Обращаем внимание учащихся на то, что на доске остались неподчеркнутые формулы веществ, с которыми они еще не знакомы. Это формулы солей.
Соли – это сложные вещества,
состоящие из ионов металла и кислотного остатка.
Как из определения, соли по составу похожи на
кислоты, только вместо ионов водорода они
содержат ионы металла.
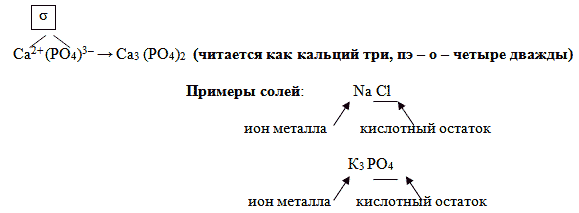
Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль NaCl может быть рассмотрена как продукт замещения водорода в соляной кислоте HCl на ион натрия. Ион натрия имеет заряд 1+, а ион хлора имеет 1–. Так как соединение нейтрально, формула поваренной соли имеет вид Na+Cl–.
Аналогично поступают и для вывода формул солей кислородосодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты – фосфата кальция. По таблице Менделеева определим заряд иона кальция, как элемента главной подгруппы II группы: 2+. По формуле фосфорной кислоты H3PO4 определим заряд иона, образованного кислотным остатком: РО43–.
Отсюда, формула фосфата кальция имеет вид:
КЛАССИФИКАЦИЯ СОЛЕЙ
В зависимости от состава кислотного остатка различают средние (нормальные) и кислые соли. Молекула средней соли состоит из ионов металла и кислотного остатка: Na NO3, К СО3.
Молекула кислой соли состоит из ионов металла и кислотного остатка, содержащего ион (ионы) водорода: Na HSO4, КН2РО4.
Кислые соли образуют только многоосновные кислоты.
Схема №1.
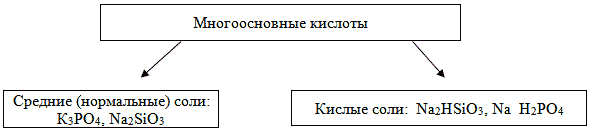
Из схемы №1 следует, что:
1. Двухосновная кислота образует одну среднюю и
одну кислую соль.
2. Трехосновная кислота образует одну среднюю и
две кислые соли.
По растворимости в воде средние соли делят на растворимые (Р), нерастворимые (Н) и малорастворимые (М) (см. таблицу растворимости кислотные основания и солей в воде №2). Почти все кислые соли растворимы в воде.
НОМЕНКЛАТУРА (НАЗВАНИЯ) СОЛЕЙ.
I. Средние соли.
Сначала указывают название кислотного остатка, затем наименование металла в родительном падеже.
1. Соли бескислородных кислот.
Название кислотного остатка составляется из русского или латинского названия элемента с добавлением суффикса «-ид».
NaCl – хлорид натрия K2S – сульфид калия
2. Соли кислородосодержащих кислот. Если кислотный остаток содержит кислообразующий элемент в высшей степени окисления, то и название добавляется суффикс «-ат».
+6 +5
Na2SO4 – сульфат натрия KNO3 – нитрат калия
При более низкой степени окисления кислотообразующего элемента добавляется суффикс «-ит».
+4 +3
Na2SO3 – сульфит натрия KNO3 – нитрит калия
Если металл проявляет переменную степень окисления, то её величину указывают римской цифрой в скобках.
Например:
FeCl2 – хлорид железа (II) FeCl2 – хлорид железа (III).
II. Кислые соли
Названия кислых солей образуют также, как и средних, только при этом к названию кислотного остатка прибавляют приставку «гидро», которая указывает на наличие в молекуле соли незамещенных ионов водорода (латинское название водорода «гидрогениум):
Na2CO3 – карбонат натрия NaHCO3 – гидрокарбонат натрия
Если в молекуле кислой соли с одним кислотным остатком связано два иона водорода, то добавляют еще и числовую приставку «-ди».
KH3PO4 – дигидрофосфат калия Ca(H2PO4)2 – дигидрофосфат кальция
Номенклатура солей приведена в таблице №1.
Номенклатура солей
Название кислоты |
Формула |
Название солей |
Формула |
| Азотистая | HNO3 | нитриты | KNO2 |
| Азотная | HNO3 | нитраты | Al(NO3)3 |
| Хлороводородная | HCl | хлориды | FeCl3 |
| Сернистая | H2SO3 | сульфиты | K2SO3 |
| Серная | H2SO4 | сульфаты | Na2SO4 |
| Сероводородная | H2S | сульфиды | FeS |
| Фосфорная | H2PO4 | фосфаты | Ca3(PO4)2 |
| Угольная | H2CO4 | карбонаты | CaCO3 |
| Кремниевая | H2SiO3 | силикаты | Na2SO3 |
Обращать внимание учащихся на таблицу
растворимости и номенклатуры солей.
Какой вывод о классификации солей по
растворимости можете делать?
Таблица №2
Растворимость солей, кислот и оснований в воде
| Ионы | H+ | NH+4 | K+ | Na+ | Ag+ | Ba2+ | Ca2+ | Mg2+ | Zn2+ | Cu2+ | Hg2+ | Pb2+ | Fe2+ | Fe3+ | Al3+ |
| OH– | P | P | P | – | P | M | M | Н | H | – | Н | Н | Н | Н | |
| NO3– | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
| Cl– | P | P | P | P | H | P | P | P | Р | P | Р | М | Р | Р | Р |
| S2 | P | P | P | P | H | – | – | – | Н | H | Н | Н | Н | Н | – |
| SO2–3 | P | P | P | P | M | M | M | M | М | – | – | Н | М | – | – |
| SO2–4 | P | P | P | P | M | H | M | P | Р | P | Р | Н | Р | Р | Р |
| CO2–3 | P | P | P | P | H | H | H | H | Н | H | – | Н | Н | – | – |
| SiO2–3 | H | – | P | P | H | H | H | H | Н | – | – | Н | Н | – | – |
| PO3–4 | P | P | P | P | H | H | H | H | Н | H | Н | Н | Н | Н | Н |
| CH3COO– | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
Р – растворимые (больше 10г. в 1000г воды); М – малорастворимые (от 10г и до 0,001г в 1000г воды); Н – нерастворимые (меньше 0,01г в 1000г воды); черточка – разлагается водой или не существуют).
Вывод.
1. Растворимы все соли азотной кислоты –
нитраты.
2. Растворимы все соли соляной кислоты – хлориды,
кроме AgCl(Н), PbSO4(H).
3. Растворимы все соли серной кислоты – сульфаты,
кроме BaSO4(H), PbSO4(H).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты,
силикаты и сульфиды, кроме этих солей Na+ и К+.
СТРУКТУРНЫЕ ФОРМУЛЫ
При изображении структурной формулы средней
соли в формуле соответствующей кислоты ионы
водорода заменяют атомом металла.
MgSO4 – сульфат магния образует серная
кислота H2SO4:
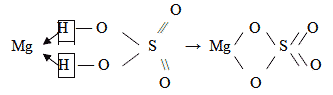
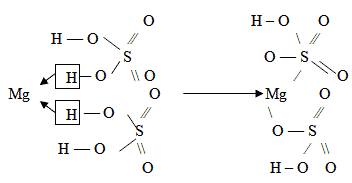
При изображении структурных формул кислых солей в формуле соответствующей кислоты атомы водорода только частично (не полностью) заменяют атомы металла.
Mg(HSO4)2 – в образовании молекул гидросульфата магния участвуют две молекулы H2SO4. Затем в каждой молекуле H2SO4 убираем по одному атому водорода.
Два атома кислорода, у которых убрали атомы водорода, соединяем с одним атомом магния, так как магний двухвалентен:
Соли имеют различные физические свойства. Соли
– кристаллические вещества различного цвета. О
растворимости солей в воде можно узнать по
таблице растворимости, в которой по вертикали
расположены знаки гидроксогрупп и кислотных
остатков, а по горизонтали – знак металлов. На
пересечении знаков металла и кислотного остатка
можно найти обозначения растворимости
соответствующих солей: Н – нерастворимая соль, М
– малорастворимая, Р – хорошо растворимая, Тире
– соль в водном растворе разлагается.
Большинство солей имеют немолекулярное
строение. Соли – твердые вещества различного
цвета. Растворимость их различна.
РАСПРОСТРАНЕННОСТЬ СОЛЕЙ В ПРИРОДЕ И РОЛЬ В ПРОЦЕССАХ ОБМЕНА ВЕЩЕСТВ В ЖИВОТНЫХ И РАСТИТЕЛЬНЫХ ОРГАНИЗМАХ
Из всех классов неорганических соединений
класс солей наиболее многочисленный.
Соли широко распространены в природе и играют
важную роль в процессе обмена веществ в животных
и растительных организмах. Соли содержатся в
клеточном соке живых организмов, входят в состав
различных тканей: костный, нервный, мышечный и др.
В организме человека содержится около 5,5% солей.
Живые организмы нуждаются в постоянном
поступлении солей извне.
Велика роль солей в хозяйстве страны. Соль
используют, например, для получения целого ряда
металлов, минеральных удобрений, стекла, моющих
веществ и т.д.
Многие соли получают в промышленности в очень
больших количествах.
Хлорид натрия
NaCl – хорошо растворимая в воде соль
под названием «поваренная соль». Без этой
соли невозможна жизнь растений, животных и
человека, так как она обеспечивает важнейшие
физиологические процессы в организмах: в крови
соль создает необходимые условия для
существования красных кровяных телец, в мышцах
обуславливает способность к возбудимости, в
желудке образует соляную кислоту, без которой
было бы невозможно переваривание и усвоение
пищи.
Необходимость соли для жизни была известна со
времен глубочайшей древности. Значение соли
отражено в многочисленных пословицах,
поговорках, обычаях.
«Хлеб да соль» – вот одно из пожеланий, которым
русские люди с древних пор обменивались, друг с
другом во время приёма пищи, подчеркивая
равноценное с хлебом значение соли.
Хлеб и соль стали символом гостеприимства и
радушия русской нации. Говорят: «Чтобы узнать
человека надо с ним пуд соли съесть».
Оказывается, ждать не так уж долго: за два года
двое съедают пуд соли (16 кг.), так как в год каждый
человек с пищей потребляет от 3 до 5,5 кг. соли.
В названиях многих городов и поселков разных
стран присутствуют слово соль: Соликамск, Соль-Илецк,
Усолье, Усолье-Сибирское, Солт-Лейк-Сити,
Зальцбург и т.д.
Соль образует мощные отложения в земной коре. В
Соль-Илецке, например, толщина пласта соли
превышает полтора километра. Соли, находящиеся в
озере Баскунчак в Астраханской области, хватит
нашей стране на 400 лет, Огромные количества соли
содержат в себе воды морей и океанов. Солью,
извлеченной из Мирового океана, можно было бы
засыпать всю сушу земного шара слоем 130 метров.
Хлорид натрия широко используют в химической
промышленности для получения натрия, хлора,
соляной кислоты, в медицине, для приготовления
пищи, для консервирования продуктов питания
(соление и квашение овощей) и т.д.
Карбонат кальция
CaCO3 – нерастворимый в воде,
важнейшая соль, из которой многочисленные
морские животные (моллюски, раки, простейшие)
строят покровы своего тела – разнообразные по
форме, многоцветные по окраске раковины.
Скапливаясь после гибели своих хозяев на дне
водоемов и главным образом морей, эти раковины за
десятки и сотни миллионов лет образовали мощные
пласты соединений кальция, давших начало
образованию горных пород – известняков CaCO3.
Эту же формулу имеет и замечательный
строительный камень – мрамор, столь привычный
каждому, стоящему у доски мел. Из известняка
получают негашеную и гашеную известь, строят
дома.
Мрамор идет на изготовление статуй, мрамором
отделаны станции московского метро.
Из этой соли наземные животные и строят свои
скелеты – внутреннюю опору для мягких тканей,
которые, в десятки раз, превышают вес самой
опоры.
Сульфат магния
MgSO4 х 7H2O (горькая соль)
содержится в морской воде и придает ей горький
вкус.
Горькую воду применяют для утяжеления хлопка и
шелка, в медицине в качестве слабительного.
Фосфат кальция
Ca(PO4)2 – нерастворим в воде, это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь было бы невозможно получение высоких урожаев. Он входит в состав костей животных.
Растворы силиката натрия
Na3SiO3 – используют для приготовления клея (с помощью силикатного клея склеивают обычно картонные изделия).
4. Закрепление изученного материала
1. С каким классом неорганических веществ вы
сегодня познакомились?
2. Выпишите из приведенных формул солей – K2S,
NaB2, Na2SiO3, Mg(H2PO4), Mg HPO4,
Mg3(PO4)2, KHS, NaHSiO3 – отдельно
средние и кислые соли, назовите их.
3. Что такое соли и как их классифицируют?
4. Какие соли называются кислыми и средними?
5. Какие вещества называются солями?
6. Какими физическими свойствами обладают соли?
7. Назовите важнейшие соли?
8. Соли в природе.
9. Соли и их применение.
10. Соли и их значение для живого мира (фауны и
флоры).
5. Заканчиваем урок подведением итогов, выставляем отметки и предлагаем домашнее задание.
Литература:
1. Журнал Химия в школе №7. 2012 год [стр. 24-25];
2. И.И. Новошинский, Н.С. Новошинская Химия 8
класс Москва « Оникс 21 век», « Мир и образование»
2003 год, [§21 стр.95];
3. О.С. Габриелян Химия 8 класс Дрофа Москва
2002г. §21 [стр.75 – 78];
4. Г.Е. Рудзитис, Ф.Г. Фельдман Химия 7-11
класс Москва «Просвещение» 1985г. [§5 стр.86];
5. С.А. Балезин, Н.Г. Ключников , В.С. Полозин Неорганическая
химия.