Связь химии с другими науками – настоящий кладезь для реализации творческих замыслов учителя по развитию познавательного интереса учащихся и их мыслительных способностей.
Межпредметные связи – проблема не новая. Имея историю, она не только не исчерпала своего значения, но и становится весьма актуальной в свете требовании, предъявляемых обществом к современной школе.
Межпредметные связи – важнейший принцип обучения. Он обеспечивает взаимосвязь предметов естественнонаучного и общественно-гуманитарного циклов и их связь с трудовым обучением школьников. С помощью связей учитель химии в сотрудничестве с учителями других предметов осуществляет целенаправленное решение комплекса учебно-воспитательных задач.
Межпредметные связи важны как для углубления общего и политехнического образования, так и для идейно-политического и нравственного воспитания, развития экономического и экологического мышления учащихся.
Перестройка средней школы, совершенствование всей системы народного образования идут по пути интеграции естественнонаучных знаний. Именно эти знания и привели в свое время к возникновению пограничных наук (биохимия, физическая химия, космохимия, электрохимия и др ), они лежат в основе развития новых видов промышленности (например, биотехнологической) и прогрессивных технологии (генная инженерия, робототехника и др.).
Межпредметные связи способствуют формированию научного мировоззрения школьников на основе современных знаний о единстве мира, о взаимодействии химической формы движения материи с физической, биологической и социальной, о взаимосвязях химической науки с идеологией, философией, моралью, искусством, с общественной практикой.
В нашей школе часто проводятся интегрированные уроки по многим предметам, цель которых обоснована многим и в частности экономия учебного времени на разных предметах.
Тип урока: решение задач.
Цели урока:
- Образовательные:
- формировать такие качества знаний учащихся как системность, глубина, осознанность, гибкость межпредметных связей;
- формировать способность понимания химических понятий, связей между ними и общими естественнонаучными понятиями;
- учить узнавать физические и химические явления, применять знания из разных тем по физике и химии для решения задач, решать комбинированные задачи.
- Развивающие:
- развивать системное и творческое мышление учащихся, формировать их познавательную активность, самостоятельность и интерес к познанию природы;
- преодолевать предметную инертность мышления и расширять кругозор учащихся.
- Воспиттательные:
- реализовывать комплексный подход к воспитанию;
- повышать уровень политехнической направленности обучения.
Оборудование: аппарат электролизер, гальванометр, источник постоянного электрического тока, соединительные провода.
ХОД УРОКА
1. Актуализация опорных знаний
Фронтальный устный опрос по теме «Электрический ток в жидкостях»
Вопросы:
1) Почему чистая дистиллированная вода – практически диэлектрик, а растворы солей, кислот и щелочей в воде – хорошие проводники.
Ответ: происходит распад нейтральных молекул на ионы под действием растворителя, т.е. электролитическая диссоциация.
2) Какой же проводимостью обладают электролиты?
Ответ: ионной.
3) Какие действия тока вам известны?
Ответ: тепловое, магнитное, химическое.
2. Объяснение нового материала
1) Демонстрация электролиза водного раствора хлорида меди (проводит учитель химии)
Ученики наблюдают выделение чистой меди и газообразного хлора на электродах при прохождении постоянного тока через раствор.

2) Объяснение составления уравнения электролиза учителем химии:
а) уравнения электролитической диссоциации (образование ионов в растворе):
CuCl2 <=> Cu2+ + 2Cl–
H2O = H+ + ОН–
б) восстановительные процессы на катоде (К–):

Cu2+ + 2e– = Cu0
в) окислительные процессы на аноде (А+):
2Сl– – 2e– = 2Cl0
г) суммарное уравнение электролиза:
CuCl2 + H2O = Сu + Cl2 + H2O
CuCl2 <=> Сu2+ + 2Cl–
Из описанного выше видно, что прохождение электрического тока через электролиты сопровождается химическими превращениями вещества и выделением газообразного хлора на аноде и чистой меди – на катоде.
3) Ученик на доске под руководством учителя химии составляет уравнение электролиза водного раствора сульфата меди.
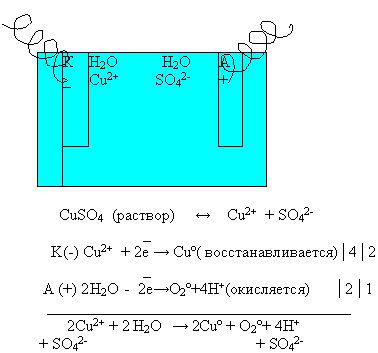
Или:
CuSO4 <=> Cu2+ + SO2–4
H2O <=> H+ + ОН–
б) К(–): Cu2+ + 2e– = Cuo (восстановление) | 2
в) A(+): 4ОН– – 4e– = O2 + 2H2O (окисление) | 1
Суммарное уравнение электролиза:
г) 2Cu SO4 + 2H2O = 2Сu + O2 + 2H2SO4
4) Ученик на доске составляет уравнение
электролиза водного раствора хлорида калия и
решает следующую расчетную задачу.
Дано 200 г 10% раствора хлорида калия. Определить
массу веществ, выделяемых на электродах.
Оценивает и комментирует решение учитель химии.
KCl <=> K+ + Cl–
H2O <=> H+ + OH–
На катоде (–): К+ , Н+
Восстановление: 2 Н+ + 2e– = Н2o
На аноде (+): Сl– , OH– Окисление:
2Сl– – 2e–
= Cl2o
2KCl +2H2O = H2 + Cl2 + 2KOH
Делаем расчет массы веществ, выделяемых на электродах.
1) m(KCl) = ?
m (KCl) = 200 . 0,1 = 20 (г), так как
концентрация 10%
n(KCl) = 0,27 моль.
Из уравнения электролиза следует, что n (Н2) =
0,135 моль; n (Cl2) = 0,135 моль
m (H2) = 0,27 г
m (Cl2) = 9,45 г
Ответ: молекулярного водорода на катоде выделяется 0,27 г, хлора на аноде – 9,45 г.
3. Решение задач
1) Учитель предлагает рассчитать, какой заряд прошел через раствор хлорида калия при электролизе.
m(H2) = m0(H+) . N(H+);
m0 ((H+)) = ![]() ;
;
q = qH+N(H+)
NH+ = ![]() =
= ![]() , где z –
валентность иона водорода.
, где z –
валентность иона водорода.
m (H2) = ![]() .
. ![]() => m(H2) = K . q, где К
– электрохимический эквивалент вещества (КH+
=
=> m(H2) = K . q, где К
– электрохимический эквивалент вещества (КH+
= 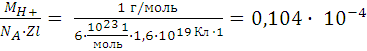 г/Кл)
г/Кл)
q = ![]() =
= ![]() = 2,6 . 104
Кл (на катоде).
= 2,6 . 104
Кл (на катоде).
КCl– = ![]() =
=
![]() = 3,6 .
10–4 г/Кл
= 3,6 .
10–4 г/Кл
q = ![]() =
= ![]() = 2,6 . 104
Кл (на аноде)
= 2,6 . 104
Кл (на аноде)
Ответ: через раствор электролита прошел q = 2,6 . 104 Кл
2) Учитель предлагает рассчитать, сколько времени будет продолжаться электролиз при силе тока I = 1A, 2A, 4А.
Из 1-го закона Фарадея: m = KI ![]()
![]() =
= ![]() =
26 . 103 c = 7,2 час.
=
26 . 103 c = 7,2 час.
При I = 2A ![]()
3) Учитель предлагает рассчитать расход электрической энергии.
A = I U t (кВт/час)
4) Далее ученикам, объединенным в малые группы (4 чел), предлагается решить по выбору пять комбинированных задач:
а) Сколько времени длилось никелирование, если на изделие осел слой никеля массой 1,8 г. Сила тока 2А. Составьте химическое уравнение электролиза.
б) Последовательно с электролитической ванной, заполненной солью никеля, включена ванна, которой находится соль хрома. После размыкания цепи в первой ванне выделилось 10 г никеля. Сколько хрома выделилось во второй ванне. Напишите уравнение электролиза.
в) Аэростат объемом 250 см3 заполняют водородом при температуре 27 oС и давлении 2 атм. Какой заряд надо пропустить при электролизе через слабый раствор серной кислоты, чтобы получить нужное количество водорода? Напишите химическое уравнение электролиза.
г) Для серебрения ложек ток 1,8А пропускался через раствор соли серебра в течение 5 ч. Катодом служит 12 ложек, каждая из которых имеет площадь поверхности 50 см3. Какой толщины слой серебра отложится на ложках? Каков расход электрической энергии, если напряжение на электролитической ванне равно 0,5В?
д) При электролизе раствора серной кислоты расходуется мощность 37Вт. Определите сопротивление электролита, если за время 50 мин выделяется 0,3 г водорода. Напишите химическое уравнение электролиза.
е) При электролизе водного раствора гидроксида калия с инертными электродами на катоде выделился молекулярный водород, объем которого при нормальных условиях равен 11,2 л. Какой объем кислорода выделится при этом на аноде?
ж) При электролизе водного раствора сульфата никеля (II) на катоде получили никель массой 177 г, выход которого составил 75%. Какой объем газа выделится при этом? Выход газа считать количественным.
ЭЛЕКТРОХИМИЧЕСКИЕ ЭКВИВАЛЕНТЫ, мг/К
Серебро 1,12
Хром 0,18
Алюминий 0,093
Никель 0,30
Кислород 0,085
4. Подведение итогов урока
Оценивание учащихся по решению расчетных задач.
5. Домашнее задание: учебник 11 класс Габриелян О.С. п. № 19. Решать (выборочно) задачи по заданному списку.