Решение задач занимает в химическом образовании важное место, так как это один из приёмов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала и вырабатывается умение самостоятельного применения приобретённых знаний. Включение задач в учебный процесс позволяет уточнять и закреплять химические понятия о веществах и процессах, вырабатывать смекалку в использовании имеющихся знаний. Задачи побуждают учащихся повторять, углублять и осмысливать имеющиеся знания. В процессе решения задач воспитывается трудолюбие, целеустремлённость, развивается чувство ответственности, упорство и настойчивость в достижении поставленной цели. При решении задач реализуются межпредметные связи, показывается единство природы. В процессе решения задач идёт сложная мыслительная деятельность. Взаимодействие знаний и действий способствует формированию разных приёмов мышления: суждений, умозаключений, доказательств.
Химические задачи можно решать устно, письменно и экспериментально, используя различные способы решения. Нельзя решать задачи от случая к случаю. Успех выработки умения решать задачи развивается, закрепляется при условии непрерывного решения задач на протяжении всего курса химии на основе созданной учителем определённой, постепенно усложняющейся системы. Как в природе всё гармонично, так и в решении задач должна быть своя гармония. Любая задача начинается с изучения её условия. Условия задач, если её нет в учебнике и сборнике задач, я предлагаю учащимся на карточках, чтобы они могли самостоятельно познакомиться с данными.
После изучения условия задачи, обязательно выясняем, с какими величинами предстоит проводить вычисления, устанавливаем единицы измерения и числовые значения данных задачи, чётко определяем искомую величину. Химические превращения записываем в виде уравнений реакций, расставляя коэффициенты перед формулами.
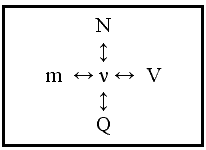
Решение любой задачи подобно сочинению музыки. Чтобы её сочинить, нужно знать ноты. Этими нотами в химии являются количественные соотношения. Взаимосвязь зависимости массы, объёма, числа частиц и теплового эффекта с количеством отражена на схеме:
Любые задачи можно решить несколькими способами. Знакомство учащихся с разными способами позволяет им самим находить пути решения. Какой способ окажется более рациональным, ребята могут сравнить на уроке или в неурочное время, использую мультимедийный проектор. На примерах я покажу несколько способов решения задач.
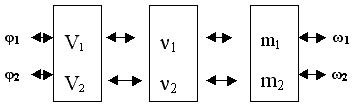
Большинство задач, связанных с переходом от одного вещества к другому, мы решаем через количественные отношения. От нот к музыкальной фразе, точно так мы идём с учащимися при решении задач. Сначала отрабатываем количественные отношения в формулах, затем между веществами. На основе этого составляем схему решения задач на смеси веществ, между которыми нет взаимодействия:
Для решения такого типа задач используем схему
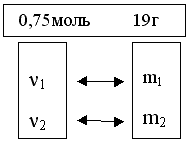
1. Смесь метана и этана массой 19 г занимает объём равный 16,8 л (при н. у.). Найти массовую или объёмную долю компонентов смеси.
Для решения многих задач используем несколько способов
1 способ.
Решение:
1. Находим общее количество смеси: vсмеси=![]()
vсмеси = ![]() = 0,75 моль
= 0,75 моль
Используем схему перехода от количества к массе
2. Пусть vметана = х моль, vэтана= 0,75-х моль
mметана = 16х(г), mэтана= 30(0,75-х)
mметана+ mэтана= 19(г)
16х +30(0,75-х)=19
14х= 3,5
Х= 0,25моль
Так как мольная доля равна объёмной доли, следовательно:
vметана= ![]() = 0,333 или 33,3%
= 0,333 или 33,3% ![]() этана= 66,7%
этана= 66,7%
mметана = 4г, mэтана=15г.
Массовую долю веществ определяем по формуле:
![]()
![]()
![]() этана=
этана=![]() = 0,78,9 или
78,9%,
= 0,78,9 или
78,9%, ![]() метана=
11,1%
метана=
11,1%
2 способ.
1. Находим общее количество смеси: vсмеси=![]()
vсмеси = ![]() = 0,75 моль
= 0,75 моль
2. Пусть х г- масса метана, (18-х)г - масса этана.
3 Находим количество веществ:
v =![]() vметана=
vметана=![]() vэтана=
vэтана=![]()
![]()
15х + 152 -8х = 180
7х =28
х=4(г)
![]()
![]()
![]() этана=
этана=![]() = 0,78,9 или
78,9%,
= 0,78,9 или
78,9%, ![]() метана=
11,1%
метана=
11,1%
vметана=![]()
vэтана=![]()
Так как мольная доля равна объёмной доли, следовательно:
![]() метана=
метана=
![]() = 0,333
или 33,3%
= 0,333
или 33,3% ![]() этана=
66,7%
этана=
66,7%
Обязательно знакомлю учащихся с графическими способами решения задач.
При решении задач графическим способом знакомлю учащихся со схемой состава бинарной системы, которую можно представить в виде отрезков прямой линии:
![]()
Начало этого отрезка соответствует содержанию одного компонента в смеси в чистом виде, конец - другому компоненту в чистом виде. В направлении от "А" к "Б" уменьшается содержание компонента "А" и увеличивается содержание компонента "Б". На оси абсцисс данные для компонентов "А" и "Б" будут иметь обратно пропорциональную зависимость.
Для нахождения массовых долей компонентов допускаем, что масса порции 19 г соответствует метану, тогда количество метана
vметана =![]()
Если масса порции 19 г соответствует этану, то его количество равно
vэтана=![]()
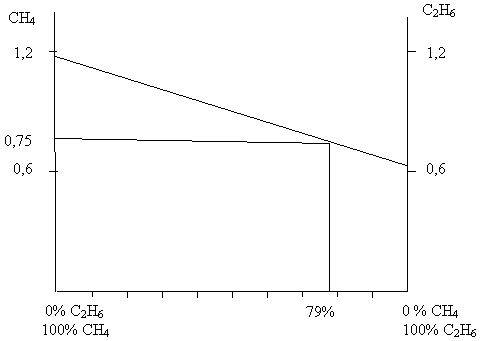
Строим график зависимости количественного содержания газов в смеси газов в смеси от массовых долей компонентов смеси. На оси ординат откладываем точку, соответствующие количеству метана. От оси абсцисс из точки, соответствующей 100% содержанию этана, проводим параллельную оси ординат и на ней откладываем точку, соответствующую содержанию в смеси этана. Соединяем эти две точки прямой и получаем график зависимости количественного содержания газов в смеси от их массовых долей.
От оси ординат на данную прямую проектируем точку, соответствующую количеству исходной смеси. Из полученной точки опускаем перпендикуляр на ось абсцисс и получаем значение массовых долей компонентов в смеси.
Метана - 21% , этана - 79%
Аналогично можно найти и объёмные доли.
При решении задач на смеси веществ, вступивших в реакцию с другими веществами можно также использовать несколько способов решения.
Задача 4. На нейтрализацию смеси азотной и серной кислот массой 35 г израсходовано 400 г раствора гидроксида калия с массовой долью 8,4%. Определить массовые доли кислот в исходной смеси.
Решение задачи любым способом начинаем с записи уравнений реакций:
1 уравнение: HNO3 + KOH = KNO3 + H2O
2 уравнение: H2SO4 + 2KOH = K2SO4 + 2H2O
При решении задач на смеси использовались схемы переходов:

1 способ.
Определяем количество гидроксида калия в растворе.
mвещества = m раствора * ![]()
m (КОН ) = 400 * 0,084 = 33,6 г
v(КОН) = 33: / 56 =0,6 моль
Пусть х - v (HNO3 ) моль y - v (H2SO4)
m (HNO3 ) = 63x m (H2SO4) = 98 y
63x + 98y = 35
Из 1 уравнения: v (КОН) = v (HNO3 ) = х моль
Из 2 уравнения: v (КОН) = 2 v (H2SO4) = 2 y моль
x + 2y = 0,6
Решаем систему уравнений:
x + 2y = 0,6
63x + 98y = 35
Из уравнения находим: x = 0,4 моль y = 0,1моль
m (H2SO4) = 9,8 г m (HNO3 ) = 25,2 г
![]() (H2SO4)
= 9,8 / 35 = 0,28 или 28%
(H2SO4)
= 9,8 / 35 = 0,28 или 28%
![]() (HNO3 )
=25,2 / 35 = 0,72 или 72%
(HNO3 )
=25,2 / 35 = 0,72 или 72%
2 способ:
Определяем количество гидроксида калия в растворе.
mвещества = m раствора * ![]()
m (КОН ) = 400 0,084 = 33,6 г
v (КОН) = 33: / 56 =0,6 моль
Пусть х - v (КОН), вступивших в реакцию с серной кислотой,
(0,6 - х) - v (КОН) вступивших в реакцию с азотной кислотой.
Из 1 уравнения: v (HNO3 ) = v (КОН) = (0,6 - х) моль
Из 2 уравнения: v (H2SO4) = 1/2 v (КОН) = 0,5х моль
m (H2SO4) = 49 х г m (HNO3 ) = 37,8 - 63х
Составляем уравнение:
49х + 37,8 - 63х = 35
Х = 0,2 моль
m (H2SO4) = 9,8 г m (HNO3 ) = 25,2 г
![]() (H2SO4)
= 9,8 / 35 = 0,28 или 28%
(H2SO4)
= 9,8 / 35 = 0,28 или 28%
![]() (HNO3 )
=25,2 / 35 = 0,72 или 72%
(HNO3 )
=25,2 / 35 = 0,72 или 72%
3 способ
Пусть х - масса H2SO4, (35-х) - масса HNO3
v (H2SO4) = х / 98моль v (HNO3 )= (35-х) /63моль
Из 1 уравнения v (КОН) = v (HNO3 )=(35-х) / 63моль
Из 2 уравнения v (КОН) = 2 v (H2SO4) = 2х / 98моль
Составляем уравнение:
(35 -х) /63 + 2х / 98=0,6
3430-98х +126х = 3704,4
х = 9,8 (г)- масса H2SO4
25,6 - масса HNO3
![]() (H2SO4)
= 9,8 / 35 = 0,28 или 28%
(H2SO4)
= 9,8 / 35 = 0,28 или 28%
![]() (HNO3 )
=25,2 / 35 = 0,72 или 72%
(HNO3 )
=25,2 / 35 = 0,72 или 72%
4 способ ( графический)
Допустим, 35г -составляет серная кислота.
v (H2SO4) =35 / 98 =0,357 моль Из 2 уравнения: v (КОН) = 2 * 0,357 = 0,714 моль
Допустим , что 35г составляет азотная кислота.
v (HNO3 ) = 0,555 моль. Из 1 уравнения: v (КОН) =0,555моль
Строим график зависимости ? (КОН) израсходованного на нейтрализацию этих кислот от массовых долей кислот в смеси.
На оси ординат откладываем ? (КОН), израсходованного на нейтрализацию серной кислоты. на оси абсцисс - массовую долю этих кислот в смеси. От оси абсцисс из точки, соответствующей 100% содержанию азотной кислоты, проводим прямую, параллельную оси ординат, и на ней отмечаем точку, соответствующую количеству гидроксида калия, израсходованного на нейтрализацию азотной кислоты. Соединяем эти две точки прямой и получаем график зависимости содержания кислот в смеси от их массовых долей. От оси ординат проектируем прямую на данный график, соответствующую количеству гидроксида калия израсходованного на нейтрализацию смеси этих кислот. Из данной точки опускаем перпендикуляр на ось абсцисс и получаем массовые доли этих кислот в смеси, только помним, что значения будут иметь обратно пропорциональную зависимость.
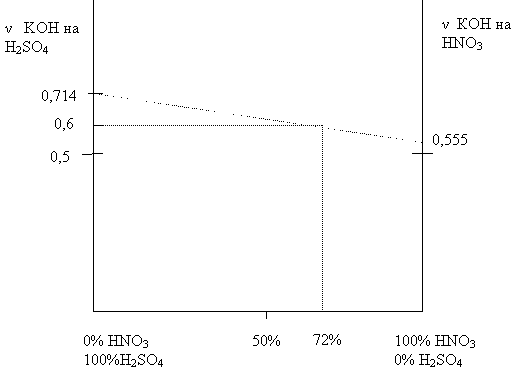
Ответ: ![]() (HNO3 ) = 72%
(HNO3 ) = 72% ![]() (H2SO4 =28%
(H2SO4 =28%
Поиск альтернативных способов решения задач активизирует учебную деятельность, использование различных технологий развивает познавательную активность и творческое мышление, а найденный удачный путь решения возвышает учащихся в собственных глазах, придаёт уверенности в своих силах и в глазах окружающих.