Тип урока:
изучение нового материала.Задачи урока:
Образовательные:
К концу урока учащиеся должны:
знать
- строение атома;
- особенности радиоактивного распада;
- законы сохранения массы и заряда при радиоактивных реакциях;
- основные открытия в области атомной физики
уметь:
- описывать, объяснять наблюдения и фундаментальные опыты, оказавшие существенное влияние на развитие физики;
- иллюстрировать роль физики в создании важнейших технических объектов.
Развивающие
:Способствовать развитию
- речи;
- интеллектуальных и творческих способностей в процессе приобретения знаний и умений по физике с использованием современных информационных технологий.
Воспитательные:
- способствовать формированию:
- познавательного интереса к предмету;
- мировоззрения учащихся.
Техническое оснащение урока:
- Компьютерный класс;
- Мультимедийный проектор, экран;
Программное обеспечение: учебное электронное издание "Открытая физика. Версия 2.6."
Создание настроя учащихся
.Слово учителя:
Атомный мир огромен, богат и : опасен. Он состоит из множества миров. Эх, увидеть бы атомы, электроны: Но: только в воображении. Умозрительно! Мы многое "видим" умозрительно, почему бы не увидеть атом? Но наука есть наука: модель будет "принята в эксплуатацию", если объяснит всю совокупность известных фактов и явлений. Всю, без единого исключения.Поэт В.Брюсов в 1922 году под впечатлением удивительных открытий физиков так дополнил модели электрона и атома:
Быть может, эти электроны -
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом -
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Нашлись ученые, которые заглянули внутрь атома и сделали великие открытия: (смотри - "история" из "Путешествие в мир атома")
М.Склодовская-Кюри( 1867-1934) - польский и французский физик и химик. Дважды лауреат Нобелевской премии. Первая( вместе с мужем) начала изучать радиоактивность. Обнаружила радиоактивность у элемента тория. Открыла вместе с супругом два новых радиоактивных элемента: полоний и радий. Определила атомный вес радия и его место в Периодической системе Д.И.Менделеева, получила радий в металлическом состоянии. Исследовала свойства радиоактивных излучений ряда элементов, выяснила влияние этих излучений на живую клетку.
И.Жолио-Кюри(1897-1956) -французский физик. Дочь П. и М.Кюри. Лауреат Нобелевской премии по химии. Открыла в 1934г. искусственную радиоактивность, получила первые искусственно созданные радиоактивные изотопы, обнаружила новый вид радиоактивного превращения - позитронный, изучала радиоактивность урана, вызванную нейтронами, ее опыты привели к открытию явления деления ядер урана. Все работы выполнены ученой совместно с супругом - Ф.Жолио-Кюри.
Изучение нового материала
Итак. В начале XX века было экспериментально доказано, что атом состоит из ядра и электронов. Резерфордом в результате опытов по рассеянию ?-частиц на тонкой фольге(см. - "эксперимент" из "Путешествие в мир атома") (золото, серебро, медь и др.) была предложена планетарная модель строения атома(см.- "модели" из "Путешествие в мир атома"). Согласно этой модели:
атом имеет положительно заряженное ядро, размеры которого малы по сравнению с размерами самого атома;
в ядре сконцентрирована почти вся масса атома;
электроны вращаются вокруг ядра по орбитам (почти как планеты вокруг Солнца).
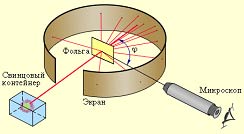
Схема опыта Резерфорда
Планетарная модель, однако, противоречит классической физике. Электрон, вращаясь с центростремительным ускорением, излучает электромагнитные волны, и это должно сопровождаться потерей энергии. В результате согласно классическим представлениям атом Резерфорда оказывается неустойчивым.
Собрать, сколько надо, частиц всех сортов,
И атом - пожалуйста - вот он, готов!
Но в общее дело их вклады неравны:
Так кто же из этих частиц самый главный -
Пузатый протон, флегматичный нейтрон,
А может быть, юркий малец электрон?..
Давайте знакомиться (см. - "знакомимся" из "Путешествие в мир атома")
Атом состоит из атомного ядра и электронов.
Электрон - это частица, заряд которой отрицателен и равен по модулю элементарному заряду e = 1,6·10-19 Кл, а масса me = 9,1·10-31 кг. Согласно планетарной модели Бора - Резерфорда электроны обращаются вокруг атомного ядра по различным орбитам.
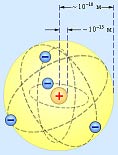
Планетарная модель атома Резерфорда.
Атомное ядро заряжено положительно. Его диаметр не превышает 10-14-10-15 м, а заряд q равен произведению элементарного заряда на порядковый номер атома Z:
q = Z·e.
Явление радиоактивности, а также опыты Резерфорда показали, что атомное ядро состоит из протонов и нейтронов, удерживаемых вместе ядерными силами. Протоны и нейтроны носят общее название нуклонов.
Протон - это частица, заряд которой положителен и равен по модулю заряду электрона: qp = +1,6·10-19 Кл, а масса mp = 1,6726·10-27 кг. Нейтрон - это нейтральная частица, масса которой равна mn = 1,6749·10-27 кг. Свободный нейтрон - нестабильная элементарная частица, которая распадается на три частицы: протон, электрон и антинейтрино.
Ядра химических элементов отличаются друг от друга количеством протонов и нейтронов. Число протонов Z равно порядковому номеру элемента в Периодической системе Менделеева. Так как атом в целом электрически нейтрален, то количество электронов в неионизированном атоме также равно Z.
Число нейтронов в атоме равно N. Общее число нуклонов в атоме равно массовому числу A
A = Z + N.
Изотопы - это атомы, ядра которых содержат одинаковое число протонов, но разное число нейтронов (т.е. атомы одного химического элемента с разным числом нейтронов в ядре). Химический элемент обозначается следующим образом:
![]()
где Z - заряд ядра, а A - его массовое
число, например, ![]()

Различные изотопы кислорода.
Для удобства измерений в физике введена атомная единица массы (а.е.м.), примерно равная массе одного нуклона: 1 а.е.м. = 1,6605·10-27 кг.
Таким образом, масса атома с массовым числом A приблизительно равна A а.е.м.
Законы классической механики оказались неприменимы к атому. Н. Бор предпринял попытку спасти планетарную модель атома Резерфорда. Он сформулировал три положения , получивших название квантовых постулатов Бора.
Атомная система может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
При переходе из стационарного состояния n в стационарное состояние m излучается (поглощается) квант, энергия которого равна разности энергий стационарных состояний:
![]()
Третий постулат Бора предлагает правило нахождения стационарных орбит.
В применении к атому водорода квантовые постулаты Бора приводят к тому, что радиусы круговых электронных орбит можно найти по формуле
rn = r1n2,
где 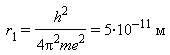 -
наименьший радиус орбиты электрона в атоме
водорода. Низшее энергетическое состояние атома
(n = 1) называется основным. Для атома
водорода энергия основного состояния равна E1 = -21,7·10-19 Дж = -13,6 эВ.
-
наименьший радиус орбиты электрона в атоме
водорода. Низшее энергетическое состояние атома
(n = 1) называется основным. Для атома
водорода энергия основного состояния равна E1 = -21,7·10-19 Дж = -13,6 эВ.
Эта энергия называется энергией ионизации.
Согласно второму постулату Бора, возможные частоты излучения атома водорода определяются формулой:
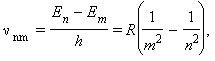
где R = 3,29·1015 Гц - постоянная Ридберга. Теория Бора объяснила возникновение линейчатых спектров и смысл целых чисел, входящих в формулы для спектральных линий водорода. Для других атомов эту теорию построить не удалось.
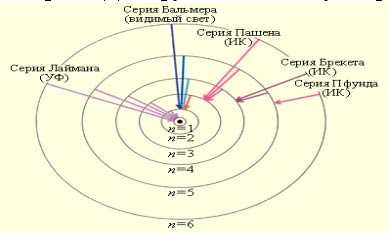
Образование спектральных серий в атоме водорода.
Постулат Бора о существовании стационарных орбит электронов в атоме находится в согласии с гипотезой де Бройля. На каждой такой орбите укладывается целое число волн де Бройля. В этом случае на стационарных орбитах образуются стоячие волны де Бройля.
Атом Резерфорда, подчиняющийся квантовым постулатам Бора, получил название атома Резерфорда-Бора.
Явление самопроизвольного превращения
неустойчивых ядер атомов в ядра других атомов с
испусканием частиц и излучением энергии
называется естественной радиоактивностью.
Почти 90 % известных ядер нестабильны.
Радиоактивные ядра могут испускать частицы трех
видов: положительно заряженные (![]() -частицы - ядра гелия), отрицательно
заряженные (
-частицы - ядра гелия), отрицательно
заряженные (![]() -частицы
- электроны) и нейтральные (
-частицы
- электроны) и нейтральные (![]() -частицы - кванты
коротковолнового электромагнитного излучения).
Магнитное поле позволяет разделить эти частицы.
-частицы - кванты
коротковолнового электромагнитного излучения).
Магнитное поле позволяет разделить эти частицы.
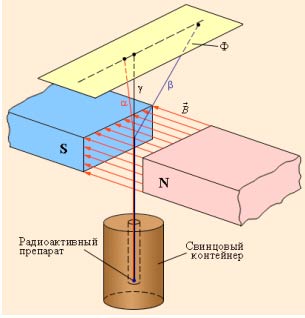
Схема опыта по обнаружению различных видов радиоактивного излучения.
Заряженные частицы регистрируются различными приборами: сцинтилляционными счетчиками, счетчиками Гейгера, камерами Вильсона и т. п.
Радиоактивные превращения ядер разделяют на два основных типа.
Альфа-распад. При альфа-распаде ядро испускает одну a-частицу, и из одного химического элемента образуется другой, расположенный на две клетки левее в периодической системе Менделеева:
![]()
Бета-распад. При бета-распаде испускается один электрон, и из одного химического элемента образуется другой, расположенный на клетку правее:
![]()
При бета-распаде из ядра вылетает еще одна
частица, называемая электронным антинейтрино.
Эта частица обозначается символом ![]()
При испускании ядрами атомов нейтральных ?-квантов ядерных превращений не происходит. Испущенный ?-квант уносит избыточную энергию возбужденного ядра; числа протонов и нейтронов в нем остаются неизменными.
Масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя < Zmp + Nmn.
Разность этих масс называется дефектом массы:
![]() M = Zmp + Nmn - Mя.
M = Zmp + Nmn - Mя.
Энергия, которая необходима для полного расщепления ядра на отдельные нуклоны, называется энергией связи. Энергию связи можно определить по дефекту массы по формуле
Eсв = ![]() M·c2.
M·c2.
Энергия связи, приходящаяся на один нуклон в ядре, называется удельной энергией связи.
Она максимальна у атомных ядер элементов в средней части таблицы Менделеева с массовыми числами A приблизительно от 40 до 100.
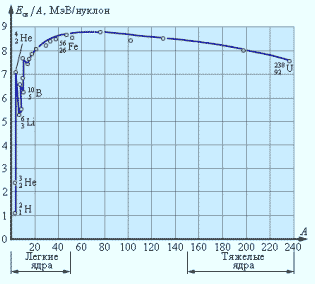
Удельная энергия связи.
Существует два способа освобождения энергии ядра - синтез легких ядер и деление тяжелых ядер.
(см. -"ядерные реакции" из "Путешествие в мир атома")
Ядерной реакцией называется процесс изменения состава и структуры атомного ядра в результате его взаимодействия с другим ядром или частицей или в результате каких-либо внутренних процессов.
Слияние легких ядер при очень высокой температуре, сопровождающееся выделением энергии, называется термоядерной реакцией (реакцией термоядерного синтеза). Термоядерные реакции являются основным источником энергии звезд.
Деление атомного ядра - это явление распада ядер на несколько более легких атомных ядер. На основе деления тяжелых элементов (урана и плутония) работают атомные электростанции.
Деление тяжелых ядер может происходить посредством цепной реакции, когда при распаде ядра выделяется частицы (нейтроны), способные вызвать реакцию деления других ядер. Цепные реакции возможны, если масса ядерного топлива превышает минимальную критическую массу.
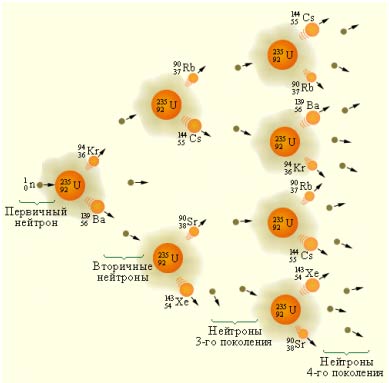
Схема развития цепной реакции.
Все это замечательно, но нельзя не обратить ваше внимание и на ОПАСНОСТЬ работы с радиоактивными материалами (см. - "опасность" из "Путешествие в мир атома")
Закрепление:
Фронтальный опрос
ВОПРОСЫ
- Какие элементарные частицы входят в состав ядра атома?
- Какие из них нестабильны в свободном состоянии?
- Что такое изотоп?
- Какой промежуток времени называют периодом полураспада?
- Кто из ученых открыл протон?
- Кто из ученых открыл нейтрон?
- Что измеряют в Беккерелях?
- Что измеряют в Греях?
- Чем знаменита М.Склодовская-Кюри?
- Какие радиоактивные химические элементы ты знаешь?
- Какая ядерная реакция была впервые вызвана ускоренными протонами? Кто осуществил эту реакцию?
- Какие два закона действуют при протекании ядерных реакций?
- К какому выводу привел опыт Э.Резерфорда по рассеянию альфа-частиц?
- Какое излучение является наиболее опасным для человека?
- Почему модель атома называют планетарной?
Ответы:
- протон и нейтрон
- нейтрон
- разновидность одного и того же химического элемента, отличающаяся массой атомов.
- в течение которого число радиоактивных атомов данного вещества уменьшается вдвое.
- Э.Резерфорд
- Дж.Чэдвик
- активность радиоактивного источника
- дозу поглощенного излучения
- исследование радиоактивного излучения и открытие новых элементов
- радий, стронций, плутоний и др.
- 73Li+11H=42He+42He, Д.Кокрофт и Е.Уолтон в 1932г.
- закон сохранения массового и зарядового чисел
- в центре атома находится положительно заряженное ядро
- проникающее бета- и гамма-излучение
- схожа с галактической моделью солнечной системы
ДЛЯ ВСЕХ
Параграфы 94, 95, 96.
Рефлексия
Сегодня на уроке мы изучали новую тему, используя возможности компьютера.
Ваше мнение об уроке: :
Сегодня я узнал(а):понял(а):удивился(ась):
Эта тема для понимания:
Литература
Дополнительные интернет-ресурсы:
- http://physicoo.narod.ru/interes/video/h1.htm-
- набор анимационных моделей атомов химических элементов.
- http://www.alhimik.ru/great/chadvik.html
- http://pavelnik.narod.ru/Sprav/Nobel/-
- снимки физиков, Нобелевских лауреатов.
- http://www.primer.ru/handbook/mendeleev/mendeleev.htm-
- сведения о химических элементах таблицы Менделеева.