Цель: проверить уровень усвоенности знаний по курсу органической химии за 10 класс.
Задачи: проверить сознательное усвоение учащимися химических свойств основных классов органических соединений и качественных реакций на них; развитие мышления и творческой активности; воспитание трудолюбия, нравственности, интереса к предмету, воспитание коллективизма, сотрудничества и взаимопомощи; формирование умения проводить химический эксперимент, предварительно проанализировав условие задачи и определив пошаговое решение; умение находить ошибки и исправлять их.
Оборудование и реактивы: водный раствор гидроксида натрия, разбавленная серная кислота, водный раствор карбоната натрия, водный раствор перманганата калия, бромная вода, водный раствор сульфата меди, аммиачный раствор оксида серебра, вода, бензойная кислота, анилин, глюкоза, формалин, этиловый спирт, сахароза, уксусная кислота, глицерин; штативы, спиртовки, спички, пробирки, держатели.
ХОД УРОКА
Этот урок лучше проводить на сдвоенном занятии. Предварительно из класса отбираются шесть учеников, которые будут контролировать ход работы. Они проходят инструктаж по ТБ проведения лабораторных опытов, сдают учителю теорию и выполняют сами опыты.
Остальной класс делится на шесть групп. Каждой группе выдается маршрутный лист с названиями станций А, Б, В, Г, Д, Е. Названия станций также указывают на то, какие органические вещества необходимо будет на них распознавать. Каждая группа предварительно подписывает сверху свои фамилии. В столбцах указывают качественную реакцию, кратко описывает ход эксперимента и, если правильно определили вещества, получают отметку о прохождении станции. За урок учащиеся успевают обойти все шесть станций.
В классе по кругу расставляются парты с реактивами по названиям станций. На каждой станции находится уже проверенный ученик – контролер. В его обязанности входит проверка правильности поставки опытов с учетом ТБ, возможность наводящей подсказки и отметка о прохождении своей станции ( знаком «+», если прошел успешно, знаком «-», если не прошел).
Им также выдаются заранее подготовленные листы контроля, на которых контролеры проставляют баллы за участие в решении поставленной задачи. Также на станциях имеются наборы реактивов и по два распознаваемых вещества.
Маршрутный лист представляет из себя нижеследующую таблицу
(целесообразно его оформлять на развернутом листе)
|
СТАНЦИЯ А |
СТАНЦИЯ Б |
СТАНЦИЯ В |
СТАНЦИЯ Г |
СТАНЦИЯ Д |
СТАНЦИЯ Е |
||||||
|
Бензойная кислота |
Анилин |
Глюкоза |
Бензойная кислота |
Формалин |
Этиловый спирт |
Глюкоза |
Сахароза |
Уксусная кислота |
Этиловый спирт |
Глюкоза |
Глицерин |
Листок контроля
|
Фамилия, имя ученика |
Теоретические знания |
Практические навыки |
Полезные советы |
Соблюдение ТБ |
Составление уравнений |
Оформление работы |
Две последние графы заполняет учитель после сдачи работы. Оценка выставляется по количеству набранных баллов.
Критерии оценки:
0 баллов – если ученик пассивен во всем;
1 балл – если дает правильные советы по теме, частично участвует в постановке опытов;
2 балла – если ученик активен во всем.
Выставление отметки:
10 – 12 баллов – отметка «5»;
8 – 10 баллов – отметка «4»;
5 – 8 баллов – отметка «3»;
меньше 5ти баллов – отметка «2».
ЗАДАЧИ НА УРОК
В вашем распоряжении имеется газовая горелка и набор реактивов:
- Водный раствор гидроксида натрия;
- Разбавленная серная кислота;
- Водный раствор карбоната натрия;
- Водный раствор перманганата калия;
- Бромная вода;
- Водный раствор сульфата меди;
- Аммиачный раствор оксида серебра;
- Вода.
и
- Бензойная кислота и анилин;
- Глюкоза и бензойная кислота;
- Формалин и этиловый спирт;
- Глюкоза и сахароза;
- Уксусная кислота и этиловый спирт;
- Глюкоза и глицерин.
С помощью минимального числа реагентов, указанных вначале, определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих реакций и оформите работу в виде отчетной таблицы (смотри домашнее задание).
РЕШЕНИЕ
СТАНЦИЯ А
1. Распознавание бензойной кислоты:
2С6Н5 – СООН + Nа2СО3 → 2С6Н5 – СООNа + Н2СО3 (разлагается на Н2О + СО2)
Ход реакции мы увидим, если опустим газотводную трубку в стакан с водой. В нем будут выделяться бесцветные пузырьки газа (СО2).
2. Распознавание анилина:
С6Н5 – NН2 + 3Вr2 → С6Н2Вr3 -NН2 + 3НВr
6 – 7 мл воды встряхнуть с 1 каплей анилина. Прибавить к этому раствору по каплям бромную воду, которая обесцвечивается и выпадает белый осадок 2,4,6-триброманилина.
СТАНЦИЯ Б
1. Распознавание глюкозы
СН2ОН – (СНОН)4 – СНО + Аg2О
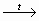 СН2ОН – (СНОН)4 – СООН + 2 Ag↓
СН2ОН – (СНОН)4 – СООН + 2 Ag↓
В пробирку наливают 1 – 2 мл раствора глюкозы в воде, прилить 1 – 2 мл аммиачного раствора оксида серебра и нагреть на водяной бане.
2. Распознавание бензойной кислоты:
2С6Н5 – СООН + Nа2СО3 → 2С6Н5 – СООNа + Н2СО3 (разлагается на Н2О + СО2)
Ход реакции мы увидим, если опустим газотводную трубку в стакан с водой. В нем будут выделяться бесцветные пузырьки газа (СО2).
СТАНЦИЯ В
1. Распознавание формалина
Н – СНО + Аg2О 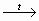 Н – СООН + 2 Аg ↓
Н – СООН + 2 Аg ↓
К 1 – 2 мл формалина прилить 1 – 2 мл аммиачного раствора оксида серебра. Равномерно нагреть пробирку, вращая вокруг пламени спиртовки, но не допускать кипения.
2. Распознавание этилового спирта.
5С2Н5ОН + 4КМnО4 + 6Н2SО4 → 5СН3 – СООН + 2К2SО4 + 4МnSО4 + 11Н2О
Налейте в пробирку 2 мл этанола, прибавьте 2 мл разбавленного раствора перманганата калия и несколько капель серной кислоты. Аккуратно нагрейте. Произойдет обесцвечивание раствора.
СТАНЦИЯ Г
1. Распознавание глюкозы
СН2ОН – (СНОН)4 – СНО + Аg2О
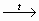 СН2ОН – (СНОН)4 – СООН + 2 Аg ↓
СН2ОН – (СНОН)4 – СООН + 2 Аg ↓
В пробирку наливают 1 – 2 мл раствора глюкозы в воде, прилить 1 – 2 мл аммиачного раствора оксида серебра и нагреть на водяной бане.
2. Распознавание сахарозы
С12Н22О11 + Н2О 
|
С6Н12О6 | + С6Н12О6 |
| глюкоза | фруктоза |
СН2ОН – (СНОН)4 – СНО + Аg2О
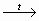 СН2ОН – (СНОН)4 – СООН +2 Аg↓
СН2ОН – (СНОН)4 – СООН +2 Аg↓
Сахароза при обычных условиях не дает реакции «серебряного зеркала», необходимо провести гидролиз. К 1 – 2 мл раствора сахарозы в воде прилить несколько капель серной кислоты. Нагреть на водяной бане. Затем вновь повторить реакцию «серебряного зеркала». Т.к. одним из продуктов гидролиза является глюкоза, реакция произойдет.
СТАНЦИЯ Д
1. Распознавание уксусной кислоты
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
СН2ОН – (СНОН)4 – СНО +
2Сu(ОН)2 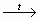 СН2ОН – (СНОН)4 – СООН + Сu2О↓
+2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О↓
+2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
СТАНЦИЯ Е
1 .Распознавание глюкозы
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
СН2ОН – (СНОН)4 – СНО +
2Сu(ОН)2 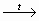 СН2ОН – (СНОН)4 – СООН + Сu2О
↓ + 2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О
↓ + 2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
2. Распознавание глицерина
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
ДОМАШНЕЕ ЗАДАНИЕ
Оформить работу в виде отчетной таблицы.
Отчетная таблица
|
Что делали |
Что наблюдали |
Уравнения реакций |
Выводы |