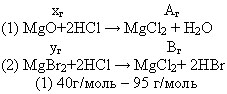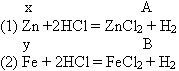Оборудование: кодоскоп, кодопозитивы.
Цели урока:
- Систематизация и повторение знаний по теме “Азотная кислота” через решение задач.
- Повторение методов решения систем линейных уравнений с двумя переменными.
- Умение применять на практике полученные знания.
- Развитие интереса к предмету.
“...одна из важнейших задач математики – помощь другим наукам”
Морделл Л.
При решении некоторых задач по химии используются математические методы. Рассмотрим несколько задач, для решения которых необходимо уметь решать системы уравнений с двумя переменными.
Задача 1: 5 г хлорида магния получено при обработке 6,5 граммов смеси оксида и бромида магния соляной кислотой. Определить состав смеси.
Объяснение начинает учитель химии.
Дано:
| m(MgO+MgBr2)= 6,5 г m(MgCl2)= 5г M(MgO)= 40 г/моль M(MgBr2)= 184г/моль M(MgCl2)= 95 г |
(1) 40г/моль – 95 г/моль |
| m(MgO)-? m(MgBr2)-? |
Составим уравнения
А + В = 6,5 г; х + у = 5
Подставим значения А и В. Решим уравнения в системе:
![]()
Объяснение продолжает учитель математики.
Вопрос. Какие методы решения систем уравнений вы знаете?
- Метод подстановки
- Метод сложения
- Графический метод
Решим систему методом сложения
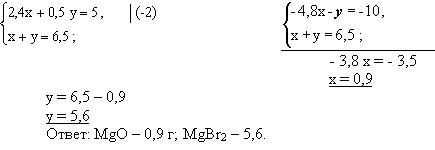
Математическую часть задачи решает 1 ученик у доски.
Задача 2: Имеется раствор, содержащий одновременно соляную и азотную кислоты. Определить массу каждой из кислот, если при нейтрализации 7 г. этого раствора расходуется 47,25 г. 20% раствора КOH.
Химическую часть задачи разбирает у доски один ученик.
Дано:
| w(КОН)=20% mр-р(KOH)= 47,25 г m(HCl + HNO3)= 7 г |
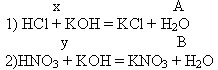 M(KOH) = 56 г/моль |
| m(HCl) – ? m(HNO3) – ? |
20% раствор – это 20 г вещества в 100 г. раствора
20 г – 100 г
х г – 47,25 г
х = 9б, 45 г – масса КОН
Составим систему уравнений.
![]()
Систему уравнений класс решает самостоятельно:
- I вариант – методом подстановки;
- II вариант – графическим методом.
а) Решение методом подстановки:
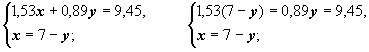
10,71 – 1,53у +0,89у = 9,45
– 0,64 у = -1,26
![]()
б) графический метод:
![]()
1 |
2 |
||
| x | y | x | y |
| 6,2 | 0 | 7 | 0 |
| 3,3 | 5 | 4 | 3 |
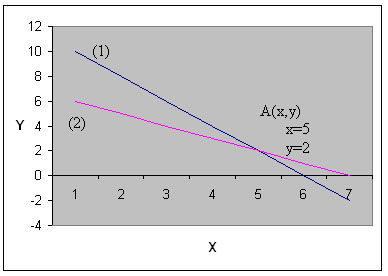
Сравниваются полученные результаты по вариантам. Проверяется правильность решения с помощью кодоскопа.
Ответ: НСl – 5 г; HNO3 – 2 г.
Третью задачу класс решает самостоятельно, сами выбирают метод решения системы. По ходу решения ребята сравнивают результаты с результатами на экране.
Задача 3: 7,5 грамма смеси цинка и железа обработали соляной кислотой, при этом выделилось 2,78 л водорода. Определите состав смеси в граммах.
Дано:
| V(H2) = 2, 78 л m(Zn + Fe) = 7,5 |
M(Zn) = 65 г/моль |
| m(Zn) – ? m(Fe) – ? |
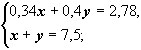
Решение методом подстановки:
![]()
0,34(7,5 – у) + 0,4 у = 2,78
2,55 – 0,34 у + 0,4 у = 2,78
0,06 у = 0, 23
![]()
б) Решение методом сложения:
![]()
| 1 | 2 | ||
| x | y | x | y |
| 8,2 | 0 | 7,5 | 0 |
| 2,3 | 5 | 2,5 | 5 |
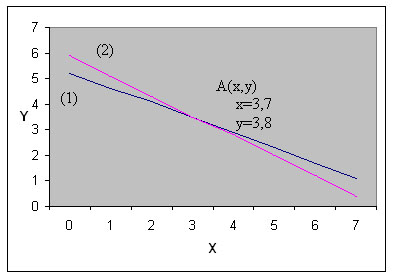
Ответ: Zn – 3,7 г; Fe – 3,8 г.
Домашнее задание
Задача: При взаимодействии нитрата серебра и 2,66 г смеси хлорида натрия и хлорида калия получено 5,74 г хлорида серебра. Сколько хлорида натрия и хлорида калия содержалось в смеси (в граммах)?
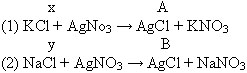
Подведение итогов урока
Математические методы используются при решении задач с практическим содержанием. Это могут быть задачи по физике, химии, расчет биополей по биологии и т.д. Надо только правильно составить уравнения, решения которых с математической точки зрения достаточно просты.