Цели урока:
- развивать познавательный интерес учащихся к химической науке,
- способствовать развитию целостного научного мышления о явлениях, науках, их взаимосвязи, реализуя межпредметные связи курсов химии, биологии, физики,
- формировать умение самостоятельно работать с источниками информации,
- развивать творческий и аналитический подход при составлении схем и их обсуждении,
- формировать умения слушать сообщения и обобщать их в виде тезисов и схем,
- использовать исторический ракурс, как полноправный методический прием, облегчающий память, прививающий интерес к науке, делающий восприятие намного легче и связаннее.
Когда учитель рассказывает о каком-нибудь открытии умалчивая о том, как люди дошли до этого открытия, он только культивирует способности пассивного восприятия и легковерное отношение к чужому слову.
В. П. Вахтеров.
Учитель.
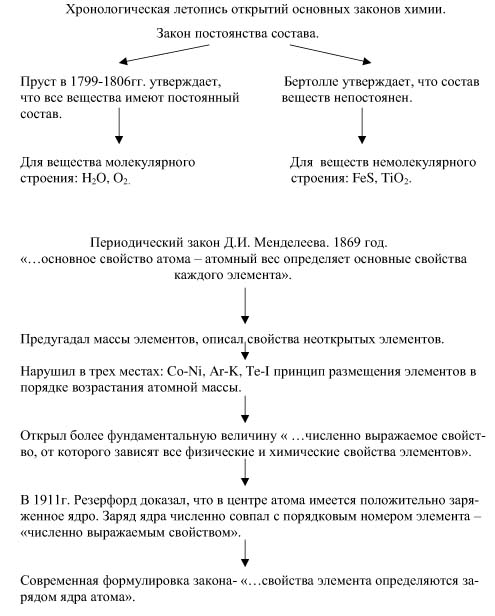
Фундаментальными законами химии являются периодический закон Д. И. Менделеева, закон постоянства состава веществ, закон сохранения массы. Рассмотрим эти законы через призму истории, выберем с вами летописца, который будет вести хронологическую запись истории открытий. Николай Гаврилович Чернышевский сказал: “ Без истории предмета нет теории предмета, но и без теории предмета нет даже мысли о его истории, потому что нет понятия о предмете, его значении и границах”. В 1799-1806 г. французский химик Жозеф Луи Пруст утверждает закон постоянства состава. Как же происходило открытие этого закона?
Ученик.
Последнее десятилетие XVII в. ознаменовалось в химии накоплением экспериментальных данных о количественном составе химических соединений, а начало XIX в. – восьмилетним спором между Бертолле и Прустом по вопросу, постоянен или нет количественный состав различных по происхождению веществ. Пруст отвечал “да”, Бертолле – “нет”. В восьмом классе мы изучали закон постоянства состава веществ в следующей формулировке: всякое чистое вещество независимо от его происхождения и способа получения имеет один и тот же состав. Но в действительности, в споре Бертолле и Пруста были правы обе стороны. Наряду с химическими соединениями, подчиняющимися закону Пруста, существуют соединения, состав которых колеблется в известных пределах в зависимости от способа получения.
Учитель.
Какие же вещества подчиняются закону Пруста, а какие нет? И почему мы не учитываем закономерность Бертолле?
Ученик.
Лишь около 5% из всех неорганических веществ
имеет молекулярное строение. И только для них
справедлив закон постоянства состава. Вещества
немолекулярного строения этому закону в полной
мере не подчиняются. Так, например, на основе
точных современных исследований установлено,
что состав сульфида железа следует изображать не
формулой FeS, а формулой Fe![]() S, где х меняет значения от 0 до 0,05, а
оксид титана не формулой TiO2, а формулой
TiO1,9-2. Но эти отклонения незначительны, и при
составлении химических формул мы их не
учитываем. Вещества немолекулярного строения не
обладают строго постоянным составом. Их состав
зависит от условий получения. Современные
представления о молекулярном и немолекулярном
строении вещества позволяют уточнить и другие
важные понятия химии. Так, например, валентность
принято определять числом связей, то это
касается только органических и неорганических
веществ молекулярного строения. Поэтому для
веществ с немолекулярным строением следует
вместо валентности применять понятие степень
окисления, а для веществ молекулярного строения
– понятие валентность.
S, где х меняет значения от 0 до 0,05, а
оксид титана не формулой TiO2, а формулой
TiO1,9-2. Но эти отклонения незначительны, и при
составлении химических формул мы их не
учитываем. Вещества немолекулярного строения не
обладают строго постоянным составом. Их состав
зависит от условий получения. Современные
представления о молекулярном и немолекулярном
строении вещества позволяют уточнить и другие
важные понятия химии. Так, например, валентность
принято определять числом связей, то это
касается только органических и неорганических
веществ молекулярного строения. Поэтому для
веществ с немолекулярным строением следует
вместо валентности применять понятие степень
окисления, а для веществ молекулярного строения
– понятие валентность.
Учитель.
Так почему же мы не учитываем закон Бертолле? Какое значение имеет закон постоянства состава? Какие расчеты можно производить с его помощью? Внимательно слушайте и записывайте расчет, который будет производиться. В качестве домашнего задания вам будет предложено самостоятельно составить задачу с применением закона постоянства состава веществ.
Ученик.
Проявление элементами определенных валентностей приводит к тому, что атомы соединяются не в произвольных соотношениях, а только в таких, которые задаются валентностями элементов. Т.е. в каких бы количественных соотношениях мы бы не взяли вещества, они вступают в реакцию только в определенном соотношении и состав вещества будет всегда постоянен. В этом заключается закон постоянства состава. Если взятые количества исходных веществ не соответствуют их соотношению в формуле, то одно из них остается в избытке. Вещества вступают в реакцию в массовых соотношениях равных соотношению их относительных атомных масс с учетом индексов. В веществе MgO соотношение масс магния и кислорода составляет:
m(Mg) : m(O) = nAr(Mg) : nAr (O) = 24 : 16 = 3 : 2
т.е. в реакцию без остатка вступают 3г магния и 2г кислорода. Значит, если до реакции их взяли в других массовых соотношениях, то одно из веществ в реакции израсходуется полностью, а другое останется в избытке. Пусть масса магния и кислорода составили по 2г. Какие вещества и в каких количествах окажутся в сосуде после реакции? Рассчитаем, сколько нужно кислорода, чтобы прореагировал весь магний? Обозначим массу кислорода через х, составим пропорцию: 3г магния реагируют с 2г кислорода, 2г магния реагируют с Хг кислорода, отсюда Х равен 1,3г. Следовательно, после реакции останется кислород, его масса будет равна 2-1,3 = 0,7г. Масса образовавшегося оксида магния складывается из масс прореагировавших магния и кислорода. Т.о. по окончании реакции получается 3,3г оксида магния и 0,7г кислорода.
Учитель.
Что же мы с вами занесем в летопись, какие два взгляда существовали на предмет состава вещества и какие вещества подчинялись этим закономерностям? До открытия периодического закона химические открытия, как правило, были неожиданными и случайными; когда химия нашла свою ведущую теорию, развитие ее получило планомерный характер. Появилась возможность предугадывать не только существование и свойства еще неоткрытых элементов и соединений, но и искать их на основании заранее известных свойств. Периодический закон открыл путь к познанию внутреннего строения атома и его ядра, практическим результатом чего явилось овладение внутриядерной энергией. Периодический закон был сформулирован Д. И. Менделеевым 1 марта 1869г. Этой работе Менделеев посвятил 15 лет непрерывного труда. 2 февраля 1907г. Менделеев скончался от воспаления легких, похоронен на Волковом кладбище в Петербуге, недалеко от могил своей матери и сына Владимира. Как же открывался этот закон?
Ученик.
Профессорами Б. М. Кедровым и С. А. Погодиным опубликованы документы, разоблачающие легенду об открытии периодического закона в результате внезапного озарения. “ Я, - говорил Менделеев своему сыну, - был с самого начала убежден в том, что самое основное свойство атомов, атомный вес или масса, должно определять основные свойства каждого элемента. Я пересмотрел массу источников, сопоставлял огромный материал. Сопоставив все, я с неотразимой ясностью увидел Периодический закон и получил полное внутреннее убеждение, что он отвечает глубочайшей внутренней природе вещей. Когда я стал окончательно оформлять мою классификацию элементов, я написал на отдельных карточках каждый элемент, его соединения и затем, расположив их в порядке групп и рядов, получил первую наглядную таблицу Периодического закона”. Это был завершающий этап творческого пути Менделеева к периодическому закону. Трудности этого этапа заключались в том, что к этому времени было известно лишь 63 элемента, а атомные массы многих элементов оставались неисправленными. Во втором периоде были известны все элементы, но атомная масса одного из них, бериллия, была вычислена неправильно: 13,5 вместо 9. Менделеев предположил, что и атомная масса и валентность бериллия были определены неверно. Из элементов четвертого ряда не был еще известен скандий. Порядок в ряду, однако, полностью восстанавливался, если за кальцием оставалось пустое место. Тем самым предусматривалось наличие в природе еще неоткрытых элементов, и три из их числа были с особенными подробностями описаны Менделеевым под названиями экаалюминий, экабор, экасилиций ( эка – второй, подобный). Подтверждение на опыте предугаданных атомных масс и особенно открытие одного за другим предсказанных элементов: галлия ( экаалюминий), скандия ( экабора), германия (экасилиция) – доставили периодическому закону всеобщее признание.
Учитель.
Давайте сделаем вывод из сказанного и запишем его в летопись. Какое свойство атома было взято за основу классификации элементов и что предугадал Менделеев? Но Менделеев предполагал, что у химических элементов есть численно выражаемое свойство, которое и определяет их свойства, еще одно свойство, кроме атомной массы. Что это за свойство?
Ученик.
В классической формулировке Менделеева периодический закон гласил: “Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомных весов”. Но в действительности, нарушив в трех местах принцип размещения элементов в порядке возрастания атомных масс, кобальт-никель, аргон-калий, теллур-иод, Менделеев открыл более фундаментальную величину – порядковый номер элемента. Физический смысл этой величины удалось вскрыть лишь много десятков лет спустя, когда было открыто строение атома. Благодаря открытию радиоактивности, ученые окончательно убедились, что в состав атомов входят электроны и положительно заряженные частицы – протоны. В 1911 году английский ученый Резерфорд доказал, что в центре атома имеется положительно заряженное ядро. Заряд ядра численно совпадает с порядковым номером элемента. Менделеев предполагал, что у химических элементов имеется численно выражаемое свойство, от которого зависят и которым однозначно определяются все физические и химические свойства каждого данного элемента и его соединений – порядковый номер элемента. И тогда после опыта Резерфорда закон Менделеева принял современное звучание: свойства элементов и образуемых им простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
Учитель.
Сделаем выводы из этого выступления и отразим их в летописи. Какую характеристику элементу мы можем дать по его положению в периодической системе?
Ученик.
По положению элемента в периодической системе мы можем определить его электронное строение, валентность, принадлежность его к s-, p-, d-, f- элементу, а отсюда можно назвать его свойства. Например, хром имеет порядковый номер 24, значит заряд его ядра + 24, он находится в 4 периоде, значит в его атоме 4 энергетических уровня, и в атоме общее число электронов равно порядковому номеру элемента, т.е.24. Т.о. число положительных и отрицательных зарядов в атоме одинаково +24 и – 24, поэтому атом хрома является электронейтральной частицей. Он находится в 6 группе, побочной подгруппе, значит это d – элемент, в его атоме заполняется электронами d - подуровень, поэтому хром имеет переменную валентность, т.к в реакциях могут участвовать электроны последнего и предпоследнего уровней, т.е. его валентность может быть равна 2,3, 6. d- элементы являются металлами, значит в химических реакциях хром является восстановителем, проявляя низшую степень окисления, отдавая электроны. В соединениях со степенью окисления +6 проявляет окислительные свойства, а в промежуточной степени окисления +3 является амфотерным, т.е. проявляет и восстановительные и окислительные свойства.
Учитель.
У нас остался последний закон – закон сохранения массы и энергии, т.е. единый закон природы. Каков его исторический фон?
Ученик.
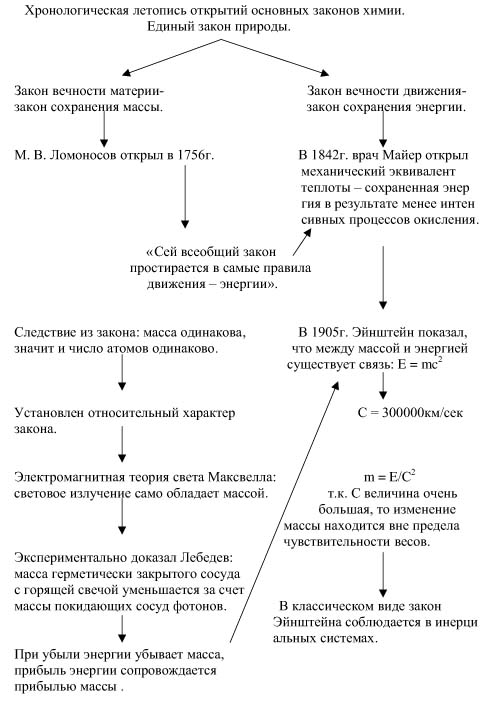
Естественно – научным выражением закона вечности материи служит закон сохранения массы, а естественно – научным выражением закона вечности движения (энергии) – закон сохранения энергии. Эти законы – наиболее общие законы естествознания: и физики, и химии, и биологии. Закон сохранения массы и энергии принято относить к химии, т.к. он впервые был сформулирован, опираясь на химические опыты. Имея на практике дело с веществами, мы хотим знать, что это за вещество и каким количеством его мы располагаем. Наиболее точным мерилом количества вещества является его масса, а наиболее удобным орудием измерения массы – весы. Особая заслуга в использовании их в целях познания природы принадлежит М. В. Ломоносову. При помощи весов им был утвержден в науке закон сохранения массы. В современной формулировке закон сохранения массы гласит: общая масса продуктов химической реакции равна общей массе веществ, вступивших в реакцию. Следствием из этого закона является то, что, если масса не изменяется и в результате реакции происходит только перераспределение атомов, то должно быть одинаковым и число атомов каждого элемента до и после реакции. Поэтому для соблюдения закона сохранения массы мы в уравнениях реакций перед формулами веществ расставляем коэффициенты. Покажем это на примере взаимодействия фосфорной кислоты с гидроксидом магния.
2H3PO4 + 3Mg(OH)2 = Mg3(PO4)2 + 6H2O
98 58 262 18
196 + 174 = 262 + 108
370 = 370
В данном уравнении реакции между левой и правой частями знак равенства не ставится, т.к. соблюдается только один закон-закон сохранения массы.
Учитель.
Что мы запишем в летопись, какие ваши мысли? Но М. В. Ломоносов рассматривал в единстве закон сохранения массы и энергии.
Ученик.
Убедившись при помощи своих весов, что охлаждение и нагревание тел, иначе говоря, прибыль и убыль теплоты не вызывают изменения массы, Ломоносов отверг господствовавший в его время взгляд на теплоту как на разновидность материи и объявил ее особой формой движения. “Сей всеобщий и естественный закон, - пишет Ломоносов, имея в виду закон сохранения, - простирается в самые правила движения, ибо тело, движущее своей силой другое, столько оного теряет, сколько сообщает другому, которое от него движение получает”. Слово движение имело смысл введенного позднее понятия “энергия”.
Учитель.
Отразим с вами взаимосвязь закона сохранения массы с законом сохранения энергии. Что же явилось предпосылкой к распространению закона сохранения на другие превращения энергии?
Ученик.
Предпосылкой к распространению закона сохранения на другие превращения энергии послужило сделанное еще в конце XVII века открытие превращения темной венозной крови при поглощении ею кислорода в ярко-алую артериальную. Судьба этого открытия весьма примечательна как пример прямой взаимосвязи в развитии трех соприкасающихся наук: физиологии, химии, физики. В 1842 г. немецкий судовой врач Р. Майер, делая в тропиках кровопускание заболевшему матросу, обратил внимание на необычно алый цвет крови и даже испугался, не вскрыл ли он вместо вены артерию. Уже давно было известно, что венозная кровь превращается в легких в алую артериальную в результате насыщения кислородом. Опираясь на кислородную теорию дыхания Лавуазье, Майер объяснил своё наблюдение следующим образом. В жарком климате организму приходится вырабатывать меньшее количество теплоты для поддержания его нормальной температуры, чем в умеренных странах. Поэтому процессы окисления внутри организма в тропиках протекают менее интенсивно, чем на севере, и неизрасходованного кислорода в крови южан перед поступлением ее в легкие остается больше, чем у северян. Это исследование и навело Майера на путь к открытию механического эквивалента теплоты. Закон сохранения энергии, помимо Майера, был открыт независимо от него и друг от друга Джоулем и Колдингом. Шире и глубже других понял значение открытого им закона Майер. Это обратилось в его личную трагедию. В разгаре борьбы за утверждение закона, начавшейся со споров о приоритете, он пытался покончить самоубийством, оставшись после этого на всю жизнь калекой.
Учитель
Да, вот такие трагедии разыгрывались в те далекие времена, но время шло и наука шла вперед. Кто же был первооткрывателем закона сохранения энергии?
Ученик.
В течение многих десятилетий закон сохранения массы в его формулировке считался абсолютно точным законом природы. Лишь такие выдающиеся мыслители как А.М. Бутлеров и Д.И. Менделеев угадывали относительный характер этого закона. Неточность закона сохранения массы в его обычной (но не ломоносовской) формулировке впервые была экспериментально установлена в результате оптических исследований. Из электромагнитной теории света Максвелла вытекало, что световое излучение само обладает массой и должно оказывать на непрозрачные препятствия, от которых оно отражается или которыми поглощается, определенное давление. Заслугой выдающегося русского физика П.Н. Лебедева является экспериментальное доказательство этой гипотезы. Следовательно, когда свеча горит в герметически закрытом, но прозрачном сосуде, то, хотя продукты реакции не покидают сосуда, масса сосуда с горящей свечой непрерывно уменьшается за счет массы покидающих сосуд фотонов.
В физике закон сохранения массы долгое время считался истиной, само собой разумеющейся. Представлялось, например, очевидным, что сумма масс осколков тела равна массе расколотого тела, что масса тела не изменяется, если оно подвергается деформации, намагничиванию, нагреванию и т.д.. Не только при излучении, но и при всякой убыли энергии убывает и масса. Наоборот, прибыль энергии сопровождается и прибылью массы. Нагретое тело имеет большую массу и весит больше, чем до нагревания; закрученная пружина – большую массу, чем до закручивания; куски раздробленного тела- большую массу, чем не раздробленного.
Учитель.
Отразим относительность закона в нашей летописи, и какие эксперименты это доказали? Почему же в результате химических реакций весы не показывают изменение массы?
Ученик.
Так как химические реакции, как правило, сопровождаются выделением или поглощением энергии, то закон сохранения массы перестает быть точным в обычной его формулировке. Убыль или прибыль массы связана с убылью или прибылью энергии соотношением Эйнштейна: E = mc2 . Возникает вопрос: почему же изменение массы за счет выделения энергии нельзя было обнаружить в химических реакциях? Ответить на этот вопрос можно, если вспомнить, что величина С исключительно большая и относительно большие прибыли и убыли энергии при химических реакциях сопровождаются столь незначительными прибылью или убылью массы, что они оказываются за пределами чувствительности весов. Например, убыль массы за счет выделения теплоты при сгорании целой платформы угля составляет несколько миллиграммов. Справедливость уравнения Эйнштейна удалось доказать при осуществлении ядерных реакций, в которых выделенная энергия в миллионы раз больше, чем при химических реакциях. Законы сохранения массы и энергии соблюдаются в инерционных системах, в земных условиях изменение массы настолько незначительно, что ее изменением мы пренебрегаем. Поэтому пользуемся законом сохранения в его классической форме. Суть этого закона выражают термохимические уравнения реакций, в которых указан тепловой эффект и в таких уравнениях ставится знак равенства. То есть термохимические уравнения выражают единый закон природы – закон сохранения массы и энергии. Примером такой реакции может быть реакция горения углерода: C + O2 = CO2 + 402,24кДж
Учитель.
Какая здесь главная мысль? Какие же системы называются инерциальными? Почему в термохимических реакциях ставится знак равенства?
Ученик.
Если какое-то тело значительно удалено от других (или защищено от их влияния), то оно находится в системе отсчета, в которой его движение прямолинейно и равномерно. Такую систему и называют инерциальной. Однако найти инерциальную систему отсчета трудно. Более того, нынешние представления об устройстве Вселенной свидетельствуют о том, что никакой связанной с конкретными телами инерциальной системы отсчета не существует и существовать не может.
Заключение.
Д.И. Менделеев, М.В. Ломоносов, Эйнштейн потому и гениальны, что проникли в тайны природы, раскрыли и объяснили суть ее законов. В периодическом законе и в периодической системе элементов ярко проявляются общие законы развития природы: закон перехода количества в качество, закон единства и борьбы противоположностей, закон отрицания отрицания, всеобщая закономерность развития по спирали. Только постигая и соблюдая законы природы, можно достичь гармонии и сохранить жизнь на планете Земля.
“ В далеком жизненном походе, как часто забываем мы, что жизнь принадлежит природе, а нам дается лишь взаймы”.
Подводятся итоги урока, в качестве домашнего задания – составить задачу на применение закона постоянства состава вещества.