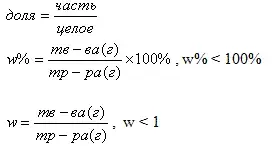Урок по теме "Растворимость веществ в воде. Растворы". 8-й класс
Скачать презентацию (4.14 МБ)
Учебник: Рудзитис Г.Е., Фельдман Ф.Г. Химия: учебник для 8 класса общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. - 12-е изд. - М.: Просвещение, ОАО «Московские учебники», 2009. - 176 с.
Цель: сформировать представление учащихся о растворимости веществ, растворах, концентрации растворов.
Задачи:
- способствовать систематизации понятийного аппарата: растворитель, растворенное вещество, раствор, растворимость веществ в воде, концентрация растворов
- «5» - обосновать, доказать; «4» - характеризовать, применить; «3» - рассказать;
- способствовать совершенствованию специальных предметных умений: решать и составлять задачи по теме «Растворы»
- способствовать формированию общеучебных умений:
- а) учебно-интеллектуальных (анализировать факты, устанавливать причинно-следственные связи; выдвигать гипотезу; сравнивать, классифицировать, делать выводы);
- б) учебно-информационных (работать с текстом, преобразовывать текстовую задачу в знаковую);
- в) учебно-организационных (понимать смысл задания, распределять время для выполнения заданий планировать работу по организации работы, осуществлять самоконтроль);
- способствовать формированию критического мышления учащихся (критически оценивать собственные знания по теме и сопоставлять их с научными);
Форма проведения: урок с использованием ИКТ, включением парных, индивидуальных форм организации учебно-познавательной деятельности учащихся.
Продолжительность учебного занятия: 90 минут.
Использование педагогических технологий: метод эвристического обучения, обучение в сотрудничестве
ХОД УРОКА
I. Организационный момент - 3 мин: мобилизующее начало (приветствие, проверка готовности к уроку, организация внимания учащихся), информация о цели и ходе урока, мотивация
II. Фронтальная беседа (12 мин)
- Как часто мы встречаемся с растворами в жизни? Какие растворы мы знаем? (Моря, реки, океаны; растворы в быту: раствор соли, раствор сахара, раствор стирального порошка и др.; медицинские
растворы и т.п.)
- Что является основой большинства известных нам растворов? (Вода)
- Давайте подумаем, как образуется раствор? (Приложение 1, слайд 2)
|
Вода |
||||
| что добавили | + растительное масло | + речной песок | + поваренная соль (NaCl) | + оксид калия (K2O) |
| Растворение | нет | нет | да | да |
| Химическая реакция | нет | нет | нет | да
K2O + Н2О --> 2КОН |
| Что образовалось | неоднородная система (эмульсия) | неоднородная система (суспензия) | однородная система (раствор) | однородная система (раствор) |
- Где произошло растворение? (В случае с поваренной солью и оксидом калия)
- Где произошла химическая реакция? (В случае с оксидом калия, образовалось новое вещество)
- В чем сходство между образованием смеси (суспензии и эмульсии) с образованием раствора?
- В чем отличие процесса растворения от химической реакцией? (Не образуется новых веществ)
III. Изучение нового материала. Объяснение учителя с элементами фронтальной беседы и решения задач. 30 мин.
1. Давайте попытаемся сформулировать, что такое раствор? (слайд 3)
Определение: растворы - это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
2. Растворимость (слайд 4) - способность вещества образовывать с другими веществами (растворителями) однородные системы - растворы
Зависит:
- От природы растворяемого вещества
- От температуры
3. Зависимость от природы растворяемых веществ (слайд 5). Все вещества делятся на:
- хорошо растворимые,
- малорастворимые,
- практически нерастворимые.
*Работа с таблицей растворимости
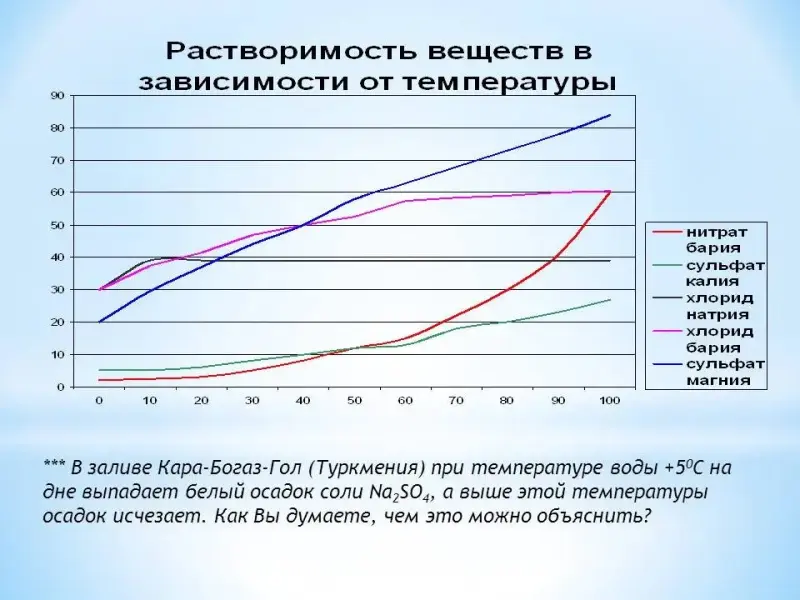
4. Зависимость растворимости веществ от температуры (слайд 6)
*Работа с графиком растворимости веществ.
*В заливе Кара-Богаз-Гол (Туркмения) при температуре воды +50С на дне выпадает белый осадок соли Na2SO4, а выше этой температуры осадок исчезает. Как Вы думаете, чем это можно
объяснить?
5. Таким образом растворы бывают (слайд 7):
|
насыщенные |
ненасыщенные |
| это растворы, в которых данное вещество при данной температуре больше растворяться не может | это растворы, в которых данное вещество при данной температуре еще может растворяться |
6. Коэффициент растворимости - это масса вещества (г), способная раствориться в одном литре растворителя (л)
Например, растворимость NANO3 равна 80,5 г/л при 100С. Это означает, что при данной температуре в одном литре воды может раствориться 80,5 г. нитрата натрия.
IV. Решим задачу (слайд 8)
В 400 мл. воды при 200С может раствориться 48 г. сульфата калия. Какова растворимость сульфата калия при данной температуре?

*** Интересный факт. Поскольку сульфат калия признан безопасной пищевой добавкой, он разрешен к применению в странах Европейского Союза и на территории Российской Федерации. Чаще всего свое применение сульфат калия как добавка находит в качестве заменителя соли. Кроме этого, он выступает в качестве регулятора кислотности в напитках
Решите задачу (слайд 9).
Задачу учащиеся решают в парах.
Тигр приготовил при 20oС 2 раствора: 5 литров раствора хлорида меди (II) - (голубой раствор) и 3 литра раствора хлорида железа (III) - (желтый раствор). Для
приготовления растворов он взял 2,8 кг. FeCl3 и 3,2 кг. СuCl2. Какой из растворов у него получился насыщенным, а какой - нет?
При 20oС растворимость СuCl2 равна 730 г/л, растворимость FeCl3 равна 920 г/л
Решение:
Растворимость СuCl2 равна 730 г/л, следовательно, для приготовления 5 литров насыщенного раствора ему нужно 730 x 5 = 3650, он взял 3,2 кг = 3200 г. Значит, раствор
ненасыщенный.
Растворимость FeCl3 равна 920 г/л следовательно, для приготовления 3 литров насыщенного раствора ему нужно 920 x 3 = 2760, он взял 2,8 кг = 2800 г. Значит, раствор
насыщенный.
7. По содержанию растворенного вещества (слайд 10)
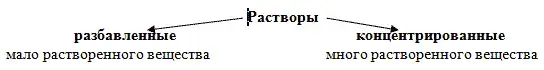
Эти понятия относительны, например
25%-ный раствор HCl - концентрированный, а
25%-ныйраствор H2SO4 - разбавленный
8. Выражение концентрации растворов (слайд 11)
Один из способов выражения концентрации растворов - массовая доля (w)
9. Решим задачи (слайд 12):.
Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в 450 г. воды.

Задача 2. Вычислите массу воды и массу соли, которые необходимо взять, чтобы приготовить 300г раствора с массовой долей 15%.

10. Решите задачи (слайды 13, 14, 15).
Задачи решаются в парах - 30 мин.
Задача 1. Для того, чтобы обработать цветы, Винни-Пуху нужно приготовить 2 кг.2%-ного раствора нитрата натрия. Помогите ему вычислить массу воды и массу соли, которые ему нужно взять?
Задача 2. Героям этого мультфильма нужно обработать музыкальные инструменты некоторым 20%-ным секретным раствором. У них есть 700 г. этого раствора с концентрацией 45%. Сколько воды им нужно долить, чтобы получить то, что нужно?
Задача 3. Выполните задание тетушки Совы. Вычислите массовую долю раствора, который получится, если 120 г. соли растворить в 1,4 кг. воды.
Задача 4. Знахарь смешал два раствора: 150 г. 25% -ного раствора и 400 г. 42%-ного раствора. Помогите ему вычислить массовую долю полученного раствора.
Задача 5. Машенька для бульона взяла 700 г. воды, добавила 1,5 чайных ложки соли (15 г.), попробовала - раствор показался ей слишком соленым, и она добавила 500 г. воды. Раствор с какой массовой долей соли получился у Машеньки в итоге?
Задача 6. Мыши помогли Золушке приготовить волшебный раствор. Они взяли два раствора: 200 г. 10%-ного раствора секретного вещества и 250 г. 25%-ного раствора этого же вещества. Затем они добавили к полученному раствору 30 г вещества. Сколько воды нужно долить Золушке, чтобы массовая доля раствора была равна 15%?
V. Проверка решенных задач на доске - 14 мин. (Приложение 2)
VI. Домашнее задание (слайд 16) - 1 мин.
- Решите задачи 1,2,3,4 стр. 81
- Составьте свою задачу по теме «Растворы». Запишите ее на карточке размером 12 см x 7 см из белого листа бумаги.
На следующем уроке мы сделаем лотерею из Ваших задач. Вы будете решать задачи друг друга и ставить друг другу оценки.