"Метод полуреакций, или электронно-ионного баланса"
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:
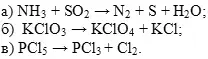
Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
![]()
3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР - методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой - восстанавливается, т.е. понижает валентность. Поэтому реакция
невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между ![]() .
.
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция
между ![]() невозможна.
невозможна.
Рассмотрим другой пример. Возможно ли взаимодействие между ионами ![]() ?
?
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут
выступать только в роли окислителя. Делают вывод: реакция между ионами ![]() и
и ![]() невозможна.
невозможна.
Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того,
при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие
схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают
отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов
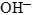 Уравнивание осуществляется за счет ионов
Уравнивание осуществляется за счет ионов 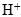 и молекул воды.
и молекул воды. - В щелочной среде ни в левой, ни в правой части не должно быть ионов
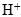 . Уравнивание осуществляется за счет ионов
. Уравнивание осуществляется за счет ионов 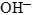 и молекул воды.
и молекул воды. - В нейтральной среде ни ионов
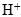 , ни
, ни 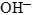 в левой части быть не должно. Однако в правой части среди
продуктов реакции они могут появиться.
в левой части быть не должно. Однако в правой части среди
продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион ![]() содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что
среда кислотная (HCl).
содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что
среда кислотная (HCl).
Полуреакция восстановления: ![]()
Ионы ![]() могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления:
могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления: ![]()

Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
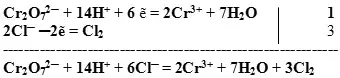
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов ![]() ─ была соль
─ была соль ![]() , поэтому с каждым молем
, поэтому с каждым молем ![]() в
раствор попадает 2 моль ионов
в
раствор попадает 2 моль ионов ![]() . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов
. В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов
![]() в раствор вносится 14 моль ионов
в раствор вносится 14 моль ионов ![]() . Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы
. Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы
![]() , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
, в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
В результате получаем:
![]()
После этого можно объединить ионы в формулы реальных веществ:
![]()
Рассмотрим другой пример.
Задача. Закончить уравнение реакции ![]() → …
→ …
Ион ![]() содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что
среда нейтральная.
содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что
среда нейтральная.
Полуреакция восстановления: ![]()
Если ион ![]() будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления:
будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления:
![]()
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
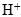 , ни
, ни 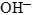 в левой части быть не должно, значит, для уравнивания атомов кислорода в
правую часть добавляем воду:
в левой части быть не должно, значит, для уравнивания атомов кислорода в
правую часть добавляем воду:
![]()
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
![]()
- Перед
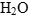 ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед 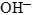 - его удвоенный коэффициент:
- его удвоенный коэффициент:
![]()
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
![]()
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
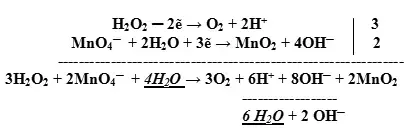
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
![]()
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
![]()
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции: ![]()
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим
полуреакцию восстановления.
Полуреакция восстановления:
![]()
- Если ион
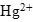 будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида
водорода в щелочной среде:
будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида
водорода в щелочной среде:
![]()
- Оформляем уравнение ОВР, протекающей в щелочной среде:
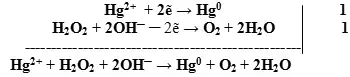
- Добавляем недостающие катионы и анионы.
![]()
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором ![]() до щавелевой кислоты в нейтральной среде.
до щавелевой кислоты в нейтральной среде.
Составляем схему реакции:
![]()
![]() выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
Следовательно, схема полуреакции восстановления имеет вид:
![]()
Схема полуреакции окисления:
![]()
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
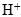 , ни
, ни 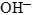 в левой части быть не должно, значит, для уравнивания атомов кислорода в
правую часть добавляем воду:
в левой части быть не должно, значит, для уравнивания атомов кислорода в
правую часть добавляем воду:
![]()
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов. Перед
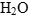 ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед 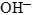 его удвоенный коэффициент.
Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
его удвоенный коэффициент.
Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
![]()
- Составляем ионное уравнение:
![]()
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
![]()
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
![]()
Ион ![]() содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию,
учитывая, что среда кислотная
содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию,
учитывая, что среда кислотная ![]() .
.
![]()
Используем правила оформления уравнений ОВР, протекающих в кислотной среде.
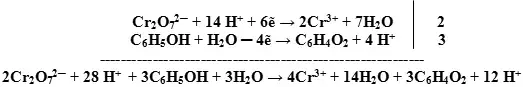
Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
![]()
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
![]()
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй - воду, в третий - концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. - М.:Дрофа,2005.