Соединения серы, их влияние на окружающую среду. 9-й класс
Скачать презентацию (4.40 МБ)
Цель урока: изучить соединения серы, их вредное воздействие на окружающую среду, используя результаты научно-исследовательской деятельности учащихся и местный экологический материал.
Задачи урока:
- На примере оксидов серы конкретизировать общее свойства кислотных оксидов.
- Закрепить знание учащихся по окислительно-восстановительным процессам.
- Показать общность химических свойств кислот.
- Рассмотреть такие понятия, как кислотные дожди, фотохимический туман (смог), разработать меры по борьбе с источниками загрязнения атмосферы.
- Рассмотреть отрицательное влияние соединений серы на природу, привлечь внимание к актуальным экологическим проблемам своей местности.
- Развивать познавательный интерес учащихся.
- Развивать практические умения и навыки, умение анализировать, сравнивать, делать выводы.
Знания, умения, навыки и качества, которые приобретут и закрепят ученики в ходе урока
В ходе урока учащиеся познакомятся с нестандартными формами ведения урока. Рассмотрят на новом качественном уровне (экологическом) о свойствах соединений серы и их влияния на окружающую среду. Закрепят знания по химическим свойствам кислотных оксидов, сернистой и серной кислот.
Оборудование: Компьютер, мультимедиа-проектор, колонки, лабораторное оборудование, химические реактивы.
ХОД УРОКА
I. Организационный момент
II. Актуализация знаний
1) Фронтальный опрос: положение серы в Периодической системе, ее физические и химические свойства.
2) Химическая разминка(Слайд 2).
а) назовите возможные степени окисления серы,
б) в каких случаях сера будет проявлять окислительные свойства, и в каких - восстановительные?
в) перечислите физические свойства серы,
г) что такое «аллотропия», какие вы знаете аллотропные модификации серы?
д) в каком виде сера встречается в природе?
е) какова роль серы в природе?
III. Изучение нового материала
Учитель предлагает вспомнить, что ребятам известно о сероводороде. Ученики предлагают свои варианты ответов.
1) Постановка проблемного вопроса (Слайд 3).
- Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе химической, текстильной, кожевенной промышленности, но, не смотря на это, он не накапливается в больших количествах в воздухе. Почему?
2) Ученики записывают реакцию взаимодействия сероводорода с кислородом:
2H2S + O2 = 2S + 2H2O
Составляют окислительно-восстановительную схему реакции.
Формулируют вывод: сероводород взаимодействует с кислородом воздуха, поэтому в больших количествах не накапливается в атмосфере. (Слайд 4)
3) Учитель рассказывает о солях сероводородной кислоты. (Слайд 5)
Учитель: При горении сера образует оксид серы ЅО2. Сейчас мы посмотрим видеоролик «Горение серы» (http://experiment.edu.ru)
4) Итак сера образует два оксида, оба они кислотные. Сравним эти оксиды. Заполним таблицу (слайд 6)
Ученики: извлекают новые знания из учебника стр. 101
Учитель при заполнении таблицы обращает внимание ребят, на знак обратимости в уравнении, который указывает на то, что сернистая кислота является слабой, неустойчивой. Она образует два ряда солей:
кислых и средних. (Слайд 7, 8)
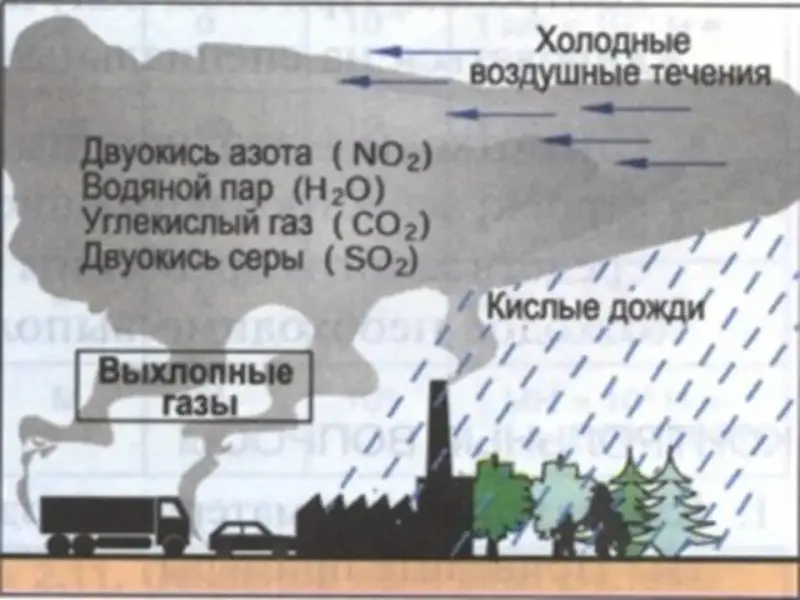
Учитель: Оксид серы ЅО2 растворяется в воде, которая всегда содержится в атмосфере. Так получается сернистая кислота, которая выпадает на Землю в виде «кислотных
дождей». Кислотные дожди - серьезная проблема для всей биосферы Земли. Они убивают рыбу и других животных, повреждают листья зеленых растений, которые вырабатывают для нас кислород, разрушают
исторические памятники архитектуры. Решением этой проблемы занимается специальная наука - экология - это наука о природе, о ее сохранении. (Слайды 9-15)
В настоящее время также сильно беспокоят природу и человечество фотохимические туманы - смог - влажностью 70%, содержащий чрезмерно токсичные примеси ЅО2; ЅО3; NО2 и
др.
Смог в основном наблюдается в осенне-зимний период (с октября по февраль). Главную опасность представляет содержащийся в нем сернистый газ, в концентрации - 5-10 мг/ м и более.
Фотохимический туман сопровождается неприятным запахом, резко снижает видимость, у людей воспаляются глаза, слизистые оболочки носа и горла, возникает удушье, обостряются легочные заболевания,
бронхиальная астма.
Фотохимический туман повреждает и растения. Сначала на листьях появляется водное набухание, нижняя поверхность листьев приобретает серебристый или бронзовый оттенок, а верхняя становится пятнистой с
белым налетом, затем наступает их быстрое увядание.
Фотохимический туман вызывает коррозию металлов, растрескивание красок, резиновых и синтетических изделий, портит одежду, нарушает работу транспорта.
Наибольшее количества ЅО2 выбрасывают тепловые электростанции и предприятия цветной металлургии, серно-кислого производства, нефтеперерабатывающая промышленность.
- Сегодня у нас на уроке ученик 11 класса Матюшин Сергей. Он занимался научно-исследовательской работой «Изучение механизма образования и влияния кислотных дождей на окружающую среду». Сергей
поставил эксперимент имитирующий образование кислотных дождей, исследовал влияния кислотных дождей на растения, вычислил массу сернистой кислоты, образующейся в результате работы котельной, составил
карту основных источников кислотных дождей на территории п. Новозавидовский.
Сейчас он сделает небольшое выступление по этой теме.
5) Выступление Матюшина С. (ученик 11 класса рассказывает о своей исследовательской работе и показывает свою презентацию - 5 мин.)
6) Фронтальная беседа.
- О каких кислородосодержащих соединениях серы мы услышали? (ЅО2; ЅО3; H2ЅО3; H2ЅО4)
- К каким оксидам относятся соединения ЅО2 и ЅО3? (К кислотным)
- Какие оксиды называются кислотными (+ H2О = кислота)
- Что собой представляет ЅО2, взаимодействует ли он с водой и что образует? (Сернистый газ, очень ядовитый с резким удушающим запахом, при растворении в воде образует сернистую
кислоту H2ЅО3)
ЅО2 + H2О <--> H2ЅО3
- Может ли сернистый газ окисляться, если да то во что? (ЅО2 окисляется в летучую жидкость - ЅО3
Записать уравнение реакции 2 ЅО2 + О2 --> 2 ЅО3 (оксид серы VІ).
- Может ли оксид серы (VІ) взаимодействовать с H2О, если да, то что при этом получается. (H2О + ЅО3 -->H2ЅО4)
Предложить схему, как из сернистого газа можно получить серную кислоту.
ЅО2 --> ЅО3 --> H2ЅО4
- Что представляет собой серная кислота? (Маслянистая, тяжелая жидкость, поглощает водяные пары. Прекрасно растворяется в воде. При растворении происходит выделение большое количества теплоты.
H2ЅО4 + nH2О --> H2ЅО4 · nH2О - гидратH2ЅО4)
7) Правила техники безопасности, которые нужно соблюдать при работе с серной кислотой:
- Разбавлять в толстостенной посуде
- Всегда приливать кислоту в воду и не наоборот.
H2ЅО4 - ядовита, огнеопасна, в концентрированном виде обугливает ткани, бумагу, кожу.
Вывод: с H2ЅО4 - нужно вести себя очень осторожно.
- Какими общими химическими свойствами обладают разбавленные кислоты в том числе и серная H2ЅО4
- взаимодействие с металлами, стоящими до H2
- взаимодействие с основными оксидами
- взаимодействие с основаниями
- взаимодействие с солями
- Как вы думаете, есть ли у H2ЅО4 - специфические химические свойства, присущие только для нее? Вспомните тему Металлы, это может вас навести на мысль.
(Да, это взаимодействие с металлами, стоящими после H2, например с Сu. Записать уравнение (составить уравнения электронного баланса)
Сuо + 2 H2ЅО4 --> СuЅО4 + ЅО2
+ 2 H2О
В зависимости от активности металлов, концентрированная серная кислота при взаимодействии с ними образует разные продукты.
Учитель: А сейчас решим задачу: (Слайд 16)
8) Вычисление массы сернистой кислоты, образующейся в результате работы котельной.
В поселке Новозавидовский проживает около 10 тысяч человек. Теплом и горячей водой жителей поселка снабжают несколько котельных, в которых до последнего времени в качестве топлива использовался
мазут.
Котельная, которая находится на территории Завидовского эксперементально - механического завода в течение отопительного сезона ежедневно сжигала около 18 т мазута. Известно, что среднее содержание
серы в топочном мазуте составляет 2,5 %. Рассчитать массу сернистой кислоты, которая может выпасть с дождем в результате суточной работы только одной котельной.
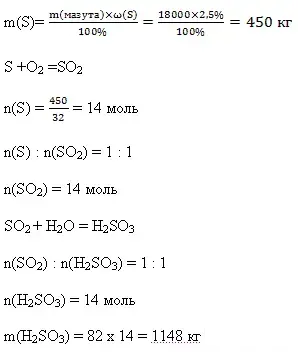 (Слайд 17)
(Слайд 17)
Вывод: тлько за одни сутки, в результате работы одной котельной образуется больше тонны сернистой кислоты. (Слайд 18)
Учитель: Итак, ребята, давайте еще раз заострим внимание: о каких соединениях мы сегодня говорили? (ЅО2; ЅО3; H2 ЅО3; H2 ЅО4).
- Вредны эти соединения? (Да, и очень)
Учитель: Какие меры защиты от воздействия вы бы предложили?
1) Ставить очистители и охладители.
2) Создавать производства, работающие по замкнутому циклу.
3) Замена углеводородного топлива на альтернативное.
4) Посадка зеленых насаждений.
Охрана природы закреплена во многих законодательных документах: (Слайд 19)
1. Конституция РФ (закреплено право человека на благоприятную окружающую среду).
2. Закон РФ «Об охране окружающей среды» (19 декабря 1991г.)
3. Законодательные акты, регулирующие использование и охрану отдельных природных ресурсов
- Земельный кодекс (23 мая 1991 г.)
- Лесной кодекс (27 января 1997 г.)
- Водный кодекс (18 октября 1995 г.)
4. Экологические службы.
5. Гринпис.
6. Движение зеленых.
IV. Итог
Учитель: На следующем уроке мы продолжим знакомство с соединениями серы, а именно подробно остановимся на вопросах получения оксидов Ѕ, промышленном способе получения серной кислоты. А также с их положительной ролью, т. е их применением в народном хозяйстве (применение их солей, которые они образуют).
V. Домашнее задание
§ 22 стр. 100-104 - (до производства H2ЅО4); упр. 3 стр. 107, упр. 5 стр. 107 (Слайд 20)