Определение уровня творческого химического мышления учащихся
Под творческим химическим мышлением понимается обобщенное качество, которое формируется на основе целого комплекса знаний и умений обучающегося в предметной области «Химия». Как известно, основными компонентами творческой деятельности являются - способность к сотрудничеству, способность мыслить творчески, способность к решению проблем (творческих задач), опыт использования знаний по химии для решения проблем и опыт технического творчества [2, 8].
Формировать творческое химическое мышление обучающихся в современной школе можно при использовании так называемого компетентностного подхода. Его основой является новое для отечественной педагогики понятие «компетенция» - готовность ученика к мобилизации знаний, умений и внешних ресурсов для эффективной деятельности в конкретной жизненной ситуации (в ситуации неопределенности). В «Концепции модернизации российского образования до 2010 года» подчеркивается, что общеобразовательная школа должна формировать так называемые ключевые компетенции учащихся, определяющие современное качество образования. К этим компетенциям относят: информационную компетенцию (готовность к работе с информацией), коммуникативную компетенцию (готовность к общению), кооперативную компетенцию (готовность к сотрудничеству) и проблемную компетенцию (готовность к решению проблем). Компетентностный подход делает акцент на получение самостоятельного опыта решения проблем.
Большие возможности по использованию компетентностного подхода открываются при организации практикумов исследовательского характера на уроках химии и организации самостоятельных исследований обучающихся во внеурочное время в малых группах (2-4 человека) [5, 6].
Основные способы диагностики творческого химического мышления представлены на рис. 1 [2]. К наиболее оригинальным методам в определении творческого мышления можно отнести анализ сочинений учащихся [2] и ответов на творческие вопросы [3-5] по адаптированной методике профессора О.С. Зайцева [2].
О развитии химического мышления судят по следующим показателям (параметрам):
- научность описания (т.е. среднее число привлеченных учений; в химии их 4: термодинамика (Т), кинетика (К), строение вещества (С) и периодичность (П); max=4);
- уровень развития письменной речи (общее число химических понятий, использованных в работе);
- доля химического аппарата (число химических понятий, названий веществ, химических формул, химической посуды, уравнений и т.д. от общего числа слов в работе*, в %);
- междисциплинарный характер (доля работ, в которых прослеживаются междисциплинарные связи, т.е. связи с другими учебными предметами, в %);
- обновляемость понятийного аппарата (доля новых терминов от их общего числа, в %).
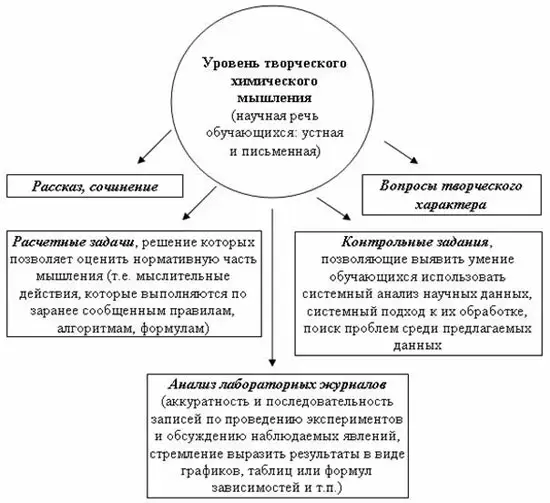
Рис. 1. Основные виды мониторинга творческого химического мышления
В качестве примера (подробный анализ работы учащегося) приведены ответы на вопросы ко второму практикуму 8 класса [4].
ВОПРОСЫ ПО РАБОТАМ ВТОРОГО ПРАКТИКУМА [1, 7]
1. Почему практический выход продукта не совпадает с теоретическим?
2. «Есть очень насыщенные минеральные источники. Стоит положить в такой источник ветку, гвоздь, что угодно, как через короткое время они обрастут множеством белых кристаллов и превратятся в подлинные произведения искусства» (Г.К.Паустовский. Золотая роза). Используя этот отрывок, составьте как можно больше химических заданий.
3. Простейший прибор для получения газов (пробирка с пробкой, через которую пропущена газоотводная трубка) можно усовершенствовать и получать в нем водород только тогда, когда есть необходимость (как в аппарате Киппа). Для этого необходимо сделать маленькое отверстие в дне пробирки и запастись химическим стаканом. Что нужно сделать дальше? Как использовать простейший прибор для получения газов, чтобы можно было получать газ и прекращать реакцию, как в аппарате Киппа? Нарисуйте схему прибора, сделав пояснительные надписи, и составьте подробную инструкцию по его использованию.
4. Количественное измерение влажности газов, в том числе и воздуха, находит применение во многих областях промышленности. Для определения влажности используют целый набор различных приборов. Предложите наиболее простой способ определения влажности газа, если в качестве измерительного устройства у вас имеются только аналитические весы. Никаких химических реактивов у вас нет.
5. На графиках (см. рис. 2) показаны кривые кислотно-основного титрования. Какую подпись нужно сделать к оси абсцисс? В каком случае титровали щелочь кислотою, а в каком кислоту щелочью?
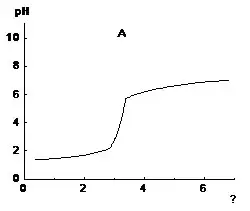
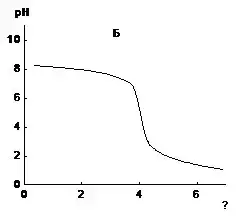
Рис.2. Кривые кислотно-основного титрования
6. Кристаллическая сода (Na2CO3'10H2O) при длительном хранении превращается в белый порошок, и при этом ее масса уменьшается более чем в 2,5 раза. Используя этот факт, напишите небольшой детективный рассказ.
В предлагаемой работе ученика 8 «Б» класса Новаковича В. новые, приобретенные обучением термины выделены жирным шрифтом, а в скобках отмечены использованные учения химии [С - строение; Т - термодинамика; К - кинетика; П - периодичность] и междисциплинарные связи [МДС]. Индексами (верхними) показана нумерация слов, относящихся к химическим понятиям, терминам, названиям веществ, посуды и т.д. (для определения доли химического аппарата). После каждого ответа на вопрос приводится дробная величина (например, 14/42, которая показывает: в числителе - число слов химического содержания, в знаменателе - общее число слов в ответе).
ОТВЕТЫ НА ВОПРОСЫ ПО РАБОТАМ ВТОРОГО ПРАКТИКУМА
Выполнил: ученик 8 «Б» класса Новакович В.
1. Практический1 выход2 продукта3 [К] не совпадает с теоретическим4 выходом5 [К], так как последний рассчитывается при условии 100 % взаимодействия исходных6веществ7 [К]. А так как в реакцию8 вступает менее 100 % исходных9 веществ10 (имеются потери, примеси11 и пр.), то практический12 выход13 всегда оказывается меньше теоретического14. ___________ 14/42
2. Задание:
1) вырастить кристалл1 определенной формы; 2) определить жесткость2 воды3 [С] источника; 3) определить минеральный4 осадок5 (минерализацию6, соленость7) [МДС]; 4) определить плотность8 [МДС] раствора9; 5) определить электропроводность10; 6) определить количество11 растворенного12 в воде13 кислорода14; 7) приготовить раствор15 заданной концентрации16 [К]; 8) определить рН17 раствора18 [С] индикаторами19 [С]; 9) определить, взаимодействует ли раствор20 с щелочами21 [С], кислотами22, оксидами23, солями24; 10) определить качественный25 состав26 [С] источника; 11) предложить способ очистки27 воды28от солей29; 12) получить пересыщенный30 раствор31 [С]. __________ 31/55
3.
 |
Рис.3. Прибор для получения водорода: 1 - пробирка1 (с отверстием в дне); 2 - химический2 стакан3; 3 - гранулы4 цинка5; 4 - газоотводная6 трубка7; 5 - каучуковая8 пробка9; 6 - раствор10 кислоты11: 7 - отверстие в пробирке12. |
Инструкция по работе с прибором13 для получения водорода14:
- налить в химический15 стакан16 раствор17 кислоты18;
- поместить в пробирку19 несколько гранул20 цинка21;
- закрыть пробирку22 каучуковой23 пробкой24 с газоотводной25 трубкой26;
- опустить пробирку27 в стакан28 с кислотой29;
- наблюдать выделение водорода30 (при необходимости собирать методом31 вытеснения32 воды33 или воздуха34) [МДС];
- для завершения химической35 реакции36 вынуть пробирку37 из химического38 стакана39 (при этом раствор40 кислоты41 вытечет и реакция42 остановится);
- при необходимости получения водорода43 снова опустить пробирку44 в химический45 стакан46. __________46/89
4. Для определения влажности1 воздуха2 [МДС] необходимо набрать образец в стеклянную3 емкость (например, в колбу4) и охладить ниже 0 0С, чтобы пары5 воды6 перешли в твердое состояние. Далее определить массу7 воды8 (использовать аналитические9 весы10). Рассчитать количество11 вещества12 воды13 и объем14 паров15 воды16. Объем17 всего воздуха18 равен объему19 колбы20, тогда объемная21 доля22 (φ23) [С] паров24 воды25 в воздухе26 будет равна:
|
φ27(Н2О28) = |
V29(Н2О30)
|
· 100 % |
__________ 32/61
5. На рисунке А рН1 возрастает от ≈ 1,2 - кислый2 раствор3 [С] (рН4 < 7) до ≈ 7,5 - щелочной5 раствор6 [С] (рН7 > 7). Следовательно, кислоту8 титруют9 [К] щелочью10 и к оси абсцисс подписываем объем11 щелочи12 - V13(щелочи14), мл15. На рисунке В рН16 убывает от ≈ 8,2 - щелочной17 раствор18 (рН19 > 7) до ≈ 1,5 - кислый20 раствор21 (рН22 < 7). Следовательно, в этом случае щелочь23 титруют24 кислотой25 и к оси абсцисс подписываем объем26 кислоты27 - V28(кислоты29), мл30. __________ 30/65
6. Многие частные предприниматели (ЧП) скупают на оптовых складах товар, в том числе уксус1, соль2, сахар3, соду4 и пр., продавая их по розничной цене. Вот такой у них бизнес! Но не всегда все проходит гладко. Однажды, занимаясь своим обычным делом, ЧП Нехимиков попал в одну щекотливую ситуацию. Если бы не БТД (Бюро тайных дел), члены которого ходили на кружок юных химиков, то карьера Нехимикова потерпела бы крах. Дело заключалось в следующем. При продаже в один продовольственный магазин соды5, директор этого магазина очень удивился, увидев пачки соды6 с надписью «1 кг7». Даже невооруженным глазом (точнее рукой) можно было обнаружить, что сода8 весила значительно меньше. Таким образом ЧП не смог реализовать свой товар. И вот за дело берется БТД. Через несколько дней расследование было закончено. Оказалось, что при длительном хранении кристаллическая9 сода10 превращается в белый порошок11 и при этом ее масса уменьшается более чем в 2,5 раза.
ЧП Нехимиков сменил сферу своей деятельности. Теперь он не торгует содой12, а занялся продажей лекарств и даже открыл свою аптеку. Пока у него все нормально. Поживем - увидим! __________ 12/172
Анализ химических понятий, использованных автором в работе и результаты анализа ответов на вопросы представлены в таблицах 1-2.
Таблица 1
Анализ химических понятий, использованных автором в работе
| № п/п |
Общий список понятий |
Новые (приобретенные в обучении термины) |
№ п/п |
Общий список понятий |
Новые (приобретенные в обучении термины) |
|
1 |
Индикаторы |
+ |
2 |
Практический выход |
+ |
|
3 |
Теоретический выход |
+ |
4 |
Исходные вещества |
+ |
|
5 |
Продукты реакции |
+ |
6 |
Химическая реакция |
|
|
7 |
Жесткость воды |
+ |
8 |
Минерализация (соленость) |
+ |
|
9 |
Раствор |
|
10 |
Количество вещества |
|
|
11 |
Концентрация |
+ |
12 |
рН раствора |
+ |
|
13 |
Щелочь |
+ |
14 |
Кислота |
|
|
15 |
Оксид |
|
16 |
Соль |
|
|
17 |
Качественный состав |
+ |
18 |
Пересыщенный раствор |
+ |
|
19 |
Влажность воздуха |
+ |
20 |
Объемная доля |
+ |
|
21 |
Титрование |
+ |
22 |
Метод вытеснения воды |
|
|
23 |
Метод вытеснения воздуха |
+ |
24 |
Кислый раствор |
+ |
|
25 |
Щелочной раствор |
+ |
26 |
Примеси |
|
|
27 |
Плотность |
+ |
28 |
Электропроводность |
|
|
Всего терминов: 28 (100%) Новых терминов: 19 (67,8%) |
|||||
Помимо ответов на вопросы для диагностики уровня творческого химического мышления удобно использовать такую форму самостоятельной работы учащихся как сочинение. Определение параметров (научность описания; уровень развития письменной речи; доля химического аппарата и др.) производится как и в ранее описанном случае. Учащимся предлагается дважды написать сочинение (без использования какой-либо справочной литературы): в начале учебного года и в конце. Тема сочинения может быть сформулирована так: «Всё, что я знаю о …» Объектом описания могут стать конкретные вещества (и их свойства), которые хорошо знакомы учащимся. Так в 8 классе можно предложить учащимся написать сочинение о воде, в 9 классе - о поваренной соли, в 10 классе - об этаноле или уксусной кислоте.
Таблица 2
Анализ ответов на контрольные вопросы (работа Новаковича В.)
|
Показатели творческого химического мышления учащегося |
|
|
Научность описания (число привлеченных учений: С, Т, П, К; max=4) |
2 (С, К) |
|
Общее число слов в работе (ОЧС) |
484 |
|
Число слов химического содержания (ХЧС): химические понятия, названия веществ, посуды, формул и пр. |
165 |
|
Доля химического аппарата (отношение ХЧС к ОЧС, выраженное в %) |
34,1 |
|
Уровень развития письменной речи: общее число химических терминов, использованных в работе (ОХТ) |
28 |
|
Новые химические термины (НХТ) (приобретенные в ходе выполнения второго практикума и из других источников) |
19 |
|
Обновляемость понятийного аппарата (отношение НХТ к ОХТ, выраженное в %) |
67,8 |
|
Междисциплинарный характер (связь с физикой, географией) |
+ |
Для определения уровня творческого химического мышления (а это, безусловно, очень кропотливая работа!) целесообразно привлекать самих учащихся, а результаты по каждому ученику и по классу в целом (средние значения) позволят объективно оценить уровень сформированного творческого химического мышления.
ЛИТЕРАТУРА
- Журин А.А. Сборник упражнений и заданий. Решение и анализ. - М., 1997.
- Зайцев О.С. Методика обучения химии: Теоретический и прикладной аспекты: Учеб. для студ. высш. учеб. заведений. - М, 1999. - С.335-353.
- Исаев Д.С. Система мониторинга сформированности творческого химического мышления и экспериментальных умений учащихся при обучении химии в средней школе//Мониторинг качества образования. - Тверь, 2006. - С.62-76.
- Исаев Д.С. Практические работы исследовательского характера по неорганической химии: Учебное пособие для учащихся 8-х классов. -Тверь, 2001. - С. 35-36.
- Исаев Д.С. Программа по химии для VIII-IX классов базового уровня образования с использованием видеодемонстраций, домашнего эксперимента и практикумов исследовательского характера. - Тверь, 2007. - С. 89-92.
- Исаев Д.С. Из опыта организации ученических исследований по химии на внеклассных занятиях в общеобразовательной школе: Пособие для учителей и студентов. - Тверь, 2007. - 100 с.
- Лисичкин Г.В., Бетанели В.И. Химики изобретают: Кн. для учащихся. - М., 1990.
- Общая методика обучения химии в школе/Р.Г. Иванова, Н.А. Городилова и др.; под ред. Р.Г. Ивановой. - М., 2008. - С. 212-216.
* При расчетах исходили из предположения, что «предложение - уравнение», «слово - химическая формула», «буква - химический знак».