Использование алгоритмов на уроках химии
Алгоритмы отрабатываются сначала в классе совместно с учителем, затем дома при выполнении домашнего задания. В результате алгоритм запоминается автоматически у более сильных учеников. При работе со слабоуспевающими учащимися проговариваем алгоритм снова и снова до тех пор, пока он не запомнится.
Личный опыт показывает высокую эффективность применения алгоритмов в обучении химии.
Алгоритм "Распределение электронов в атоме ХЭ"
| 1. Запиши химический символ элемента. |
Распределение электронов в атоме ХЭ Кол-во e (N) на данном ЭУ: N = 2n2
1-й ЭУ
1s… 2-й ЭУ
3-й ЭУ
4-й ЭУ 4s… 4р… 4d… 4f… |
|||||||||||||||||||
| 2. Слева снизу укажи заряд ядра его атома. | ||||||||||||||||||||
| 3. Определи количество электронов в атоме ХЭ. | ||||||||||||||||||||
| 4. Выясни количество энергетических уровней в атоме данного ХЭ ( = № периода!!!) | ||||||||||||||||||||
| 5. Запиши распределение электронов по ЭУ (под "дугами") | ||||||||||||||||||||
| 6. Запиши графическую формулу 1-го ЭУ ("квадратик", "стрелки"). | ||||||||||||||||||||
| 7. Напиши электронную формулу 1-го ЭУ-1s… | ||||||||||||||||||||
| 8. Запиши графическую формулу 2-го ЭУ ("квадратик", "стрелки"). | ||||||||||||||||||||
| 9. Напиши электронную формулу 2-го ЭУ - 2s… 2р… | ||||||||||||||||||||
| 10. Запиши графическую формулу 3-го ЭУ ("квадратик", "стрелки"). | ||||||||||||||||||||
| 11. Напиши электронную формулу 3-го ЭУ - 3s… 3р… 3d… | ||||||||||||||||||||
| 12. Если имеется 4-й ЭУ - запиши распределение электронов аналогично. | ||||||||||||||||||||
| Количество электронов на ВЭУ = № группы. |
Химичекий идеал - 8 электронов на внешнем энергетическом уровне.

В результате отдачи-принятия электронов образуются химические соединения (вещества).
Алгоритм "Определение типа ХС в соединении"
| 1. Определи состав соединения - металл-неметалл или неметалл-неметалл. | |
| 2. Установи тип ХС - ионная, ковалентная (полярная, неполярная). | |
| 3. Если связь ионная: | 3. Если связь ковалентная: |
| 4. Запиши электронное строение "соединяющихся" атомов по энергетическим уровням ("ДУГИ") | 4. Запиши электронное строение ВЭУ каждого из "соединяющихся" атомов в виде графической электронной формулы ("СТРЕЛКИ", "квадратики"). |
| 5. Выясни, сколько электронов может отдать металл для достижения "химического идеала" | 5. Определи количество неспаренных электронов в атомах каждого ХЭ по графической электронной формуле. |
| 6. Выясни, сколько электронов необходимо принять неметаллу для достижения "химического идеала". | 6. Определи количество обобществляющихся электронов и количество образующихся общих электронных пар. |
| 7. Стрелкой покажи переход электронов от металла к неметаллу. | 7. Выясни значение электроотрица - тельности ХЭ в соединении. |
| 8. Если необходимо - допиши атом металла (неметалла). | 8. Запиши структурную формулу соединения, указав точками общие электронные пары в ( ), учитывая смещение общей электронной пары в сторону более ЭО-го ХЭ (если связь ков. пол.) |
| 9. Укажи состав образовавшихся ионов. | |
Степень окисления
|
Степень окисления |
Примеры |
|
0 |
В атомах простых веществ: Na, Fe, O2, N2, B |
|
+ |
Металлы в соединениях: Na+Cl, Fe+2Br2, Fe+3Br3, Ca+2O
Менее электроотрицательные ХЭ в соединения: H+Cl, H2+O, NH3+, CH4+ |
|
- |
Неметаллы в соединениях: NaCl-, FeBr2-, FeBr3-, CaO-2
Более электроотрицательные ХЭ: HF-, H2O-2, N-3H3 |
Алгоритм составления формулы вещества по известной степени окисления.
|
1. Запиши знаки ХЭ рядом.
2. Металл на первом месте, затем неметалл. FeBr
|
|
3. По периодической системе определи степени окисления каждого ХЭ, учитывая характер ХЭ - металл (отдает электроны) или неметалл (принимает электроны)
Fe+3Br - 1 N+3O- 2 |
|
4. Найди наименьшее общее кратное значение степеней окисления ХЭ, образующих вещество.
3 10
|
|
5. Раздели наименьшее общее кратное на степень окисления металла (менее электроотрицательного ХЭ) > получишь индекс этого ХЭ, запиши индекс справо снизу этого ХЭ.
3 10
|
|
6. Раздели наименьшее общее кратное на степень окисления неметалла (более электроотрицательного ХЭ) > получишь индекс этого ХЭ, запиши индекс справо снизу этого ХЭ.
3 10
|
7. Назови соединение.
|
Алгоритм для решения задач
| 1. Составь и запиши "Дано:" - для этого определи, какие вещества взяли и какие получили в результате реакции. |
| 2. Определи, что необходимо найти (какую массу вещества или его количество или другие параметры). |
| 3. В решении составь и запиши уравнение химической реакции. |
| 4. Над формулами веществ запиши известные данные (только для чистых веществ, то есть не содержащих примеси). |
| 5. Над уравнением над формулами веществ запиши неизвестные величины, которые необходимо найти - обозначь их за "х". |
| 6. Выполни расчеты по уравнению: найди относительную молекулярную, молярную массы и массу по уравнению веществ, с которыми работаешь решая задачу. Запиши эти данные под уравнением. |
| 7. Составь и реши пропорцию. |
| 8. Запиши ответ. |
Генетическая связь между классами неорганических соединений
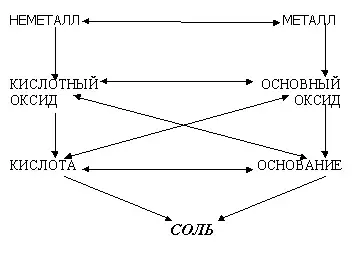
Алгоритм "Электролиз водного раствора"
|
1. Запиши уравнение диссоциации соли. |
|
|
2. Запиши уравнение диссоциации воды. |
|
| 3. Запиши ионы, направляющиеся к катоду (учитывай диссоциацию молекул воды). | 3. Запиши ионы, направляющиеся к аноду (учитывай диссоциацию молекул воды). |
| 4. По электрохимическому ряду напряжений металлов определи положение металла, входящего в состав соли. | 4. Выясни состав аниона (кислородсодержащий или бескислородный) |
|
5. Если металл находится правее водорода, то восстанавливается именно он:
Сu+2 + 2ё --> Сuо |
5. Если анион бескислородный, то окисляется именно он:
S - 2 - 2ё --> Sо |
|
5. Если металл находится левее Al (включительно), то восстанавлив- ливаются
2Н+ + 2ё --> Н2о |
6. Если анион кислородсодержащий, то происходит окисление
4ОН- - 4ё --> 2Н2О |
|
5. Если металл находится правее Al, но левее водорода, то возможно протекание одновременно
2Н+ + 2ё --> Н2о Мn+2 + 2ё --> Мnо |
|
КАК НАЗВАТЬ органическое соединение
| 1. Определи принадлежность вещества к определенному классу - по наличию кратных связей, функциональных групп. СУФФИКС!!! |
| 2. Пронумеруй самую длинную цепь атомов углерода (или цикл из атомов С) с того края молекулы, к которому ближе кратная связь или функциональная группа. |
| 3. Установи нахождение кратных связей или радикальных групп в углеводородной цепи. |
| 4. Назови радикальные группы, их локализацию. |
| 5. Дай полное название органическому веществу. |
КАК НАПИСАТЬ формулу вещества по названию
| 1. В названии вещества определите количество атомов углерода в самой длинной цепи. |
| 2. Запишите цепь из атомов углерода. |
| 3. По суффиксу определите принадлежность вещества к конкретному классу и дополните углеводородную цепь кратными связями или функциональной группой. |
| 4. Выделите названия радикалов и их локализацию. Напишите их формулы в углеводородной цепи. |
| 5. Дополните структурную формулу атомами водорода согласно валентности углерода = IV. |
Типичные реакции
Кислот
1. КИСЛОТА + ОСНОВАНИЕ --> СОЛЬ + ВОДА
H2SO4 + 2NaOH --> Na2SO4 + 2H2O
2. КИСЛОТА + ОКСИД МЕТАЛЛА > СОЛЬ + ВОДА
HNO3 + K2O --> KNO3 + H2O
3. КИСЛОТА + МЕТАЛЛ --> СОЛЬ + ВОДОРОД
2HCl + Zn --> ZnCl2 + H2
4. КИСЛОТА + СОЛЬ --> НОВАЯ КИСЛОТА + НОВАЯ СОЛЬ
H2SO4 + 2NaCl --> 2HCl + Na2SO4
Солей
1. СОЛЬ + КИСЛОТА --> ДРУГАЯ СОЛЬ + ДРУГАЯ КИСЛОТА
2. СОЛЬ + ЩЕЛОЧЬ --> ДРУГАЯ СОЛЬ + ДРУГОЕ ОСНОВАНИЕ
3. СОЛЬ + МЕТАЛЛ --> ДРУГАЯ СОЛЬ + ДРУГОЙ МЕТАЛЛ
4. СОЛЬ1 + СОЛЬ2 --> СОЛЬ3 + СОЛЬ4
Оснований
1. ОСНОВАНИЕ + КИСЛОТА --> СОЛЬ + ВОДА
H2SO4 + 2NaOH --> Na2SO4 + 2H2O
2. ЩЕЛОЧЬ + ОКСИД НЕМЕТАЛЛА > СОЛЬ + ВОДА
2LiOH + CO2 --> Li2CO3 + H2O
3. ЩЕЛОЧЬ + СОЛЬ --> НОВОЕ ОСНОВАНИЕ + НОВАЯ СОЛЬ
2KOH + CuCl2 --> Cu(OH)2 + 2KCl
4. НЕРАСТВОРИМОЕ ОСНОВАНИЕ --> ОКСИД МЕТАЛЛА + ВОДА
Cu(ОН)2 --> CuО + H2O
Основных оксидов
1. ОСНОВНЫЙ ОКСИД + КИСЛОТА --> СОЛЬ + ВОДА
HNO3 + K2O --> KNO3 + H2O
2. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД --> СОЛЬ
Na2O + SO3 --> Na2SO4
3. ОСНОВНЫЙ ОКСИД + ВОДА --> ЩЕЛОЧЬ (ОКСИД АКТИВНОГО МЕТАЛЛА)
Li2O + H2O --> 2LiOH
Кислотнх оксидов
1. КИСЛОТНЫЙ ОКСИД + ЩЕЛОЧЬ --> СОЛЬ + ВОДА
2LiOH + CO2 --> Li2CO3 + H2O
2. КИСЛОТНЫЙ ОКСИД + ОСНОВНОЙ ОКСИД --> СОЛЬ
Na2O + CO2 --> Na2CO3
3. КИСЛОТНЫЙ ОКСИД + ВОДА --> КИСЛОТА
SO3 + H2O --> H2SO4