Задачи урока:
Образовательные:
- Определить положение азота в Периодической системе Д.И.Менделеева.
- Познакомить учащихся с нахождением азота в природе
- Рассмотреть строение атома азота.
- Дать характеристику физическим свойствам азота.
- Дать характеристику химическим свойствам азота.
- Познакомить с областями применения азота.
Развивающие:
- Продолжить формирование умений учащихся на основании положения элементов в Периодической системе, определять строение атомов.
- Продолжить формирование умений учащихся на основании электронного строения атомов предполагать химические свойства элементов и оценивать возможность изменения этих свойств.
- Продолжить формирование умений учащихся составлять уравнения окислительно-восстановительных реакций.
Воспитывающие:
- Продолжить формирование у учащихся навыков логического мышления, умений делать выводы, обобщать и сравнивать.
Оборудование:
- Периодическая система химических элементов Д.И.Менделеева,
- Учебник “Химия – 9” И.И Новошинский, Н.С. Новошинская
- компьютер,
- проектор,
- электронная презентация урока PowerPoint “Азот” (Презентация)
Тип урока: изучение нового учебного материала.
Ход урока
I. Организационный момент
Тема урока на слайде 1.
II. Вводная часть
Рассмотрев на прошлом уроке общую характеристику элементов V группы главной подгруппы, мы переходим к подробному изучению азота.
III. Основная часть урока
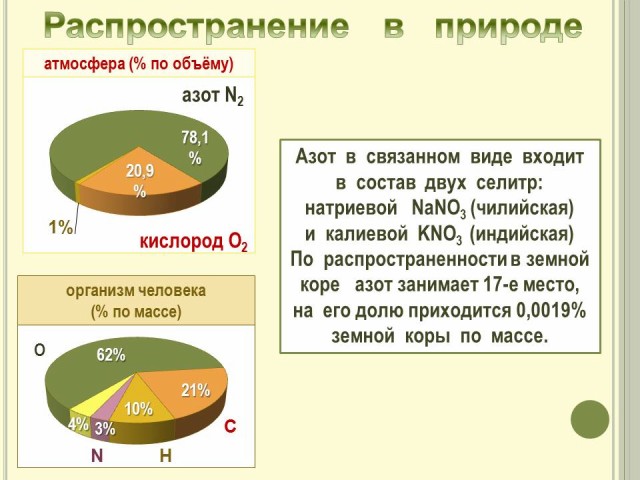
1. Нахождение в природе.
В природе азот встречается как в свободном состоянии, так и в составе соединений.
(Слайд № 2).
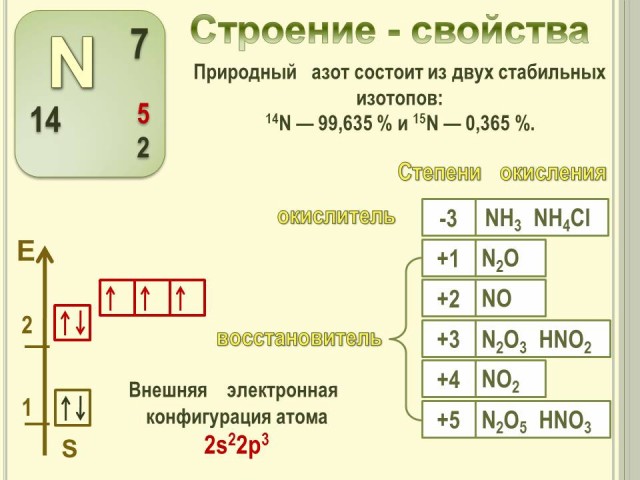
2. Строение – свойства. (Слайд № 3).
- Как определить заряд ядра атома и количество энергетических уровней?
- Как определить число электронов на внешнем энергетическом уровне?
- Как записать электронную формулу внешнего энергетического уровня атома азота?
Рассматриваем заполнение энергетических уровней атома азота, определяем валентные возможности атома, вероятные степени окисления и примеры веществ с данными степенями окисления.
Проводим сравнение окислительно-восстановительных возможностей азота, определив высшую, низшую и промежуточные степени окисления
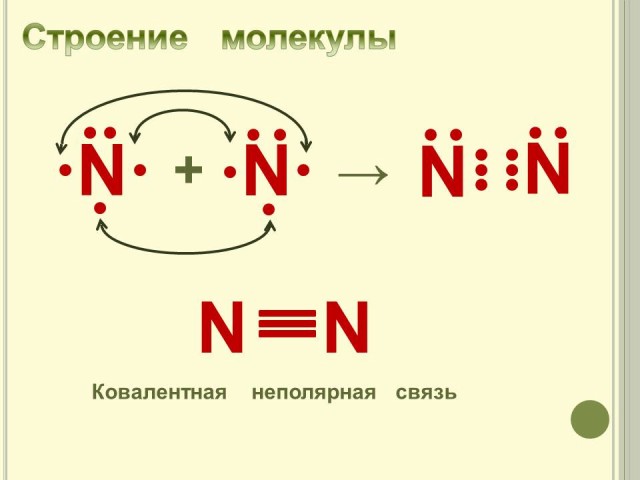
3. Строение молекулы. (Слайд № 4).
Составляем схему образования молекулы азота, определяем количество и тип химических связей. Какова может быть прочность связи в такой молекуле?
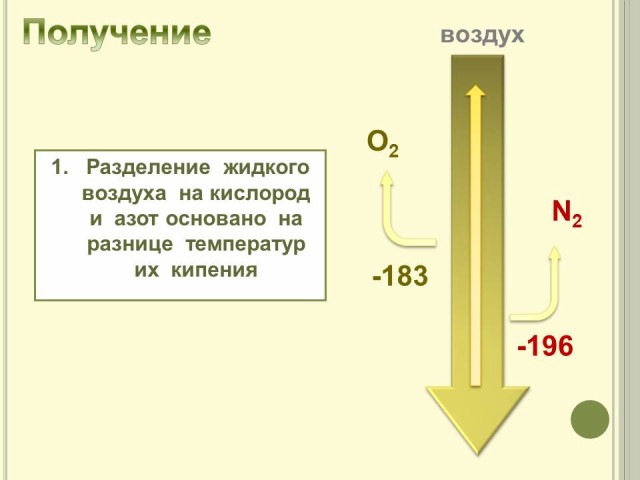
4. Получение азота.
Рассмотрим основные способы получения азота.
- В промышленности (Слайд № 5).
- В лаборатории (Слайд № 6).
В уравнениях реакции необходимо расставить коэффициенты методом электронного баланса (проверка по слайду).
5. Физические свойства азота. (Слайд № 7).
Знакомимся с физическими свойствами азота.
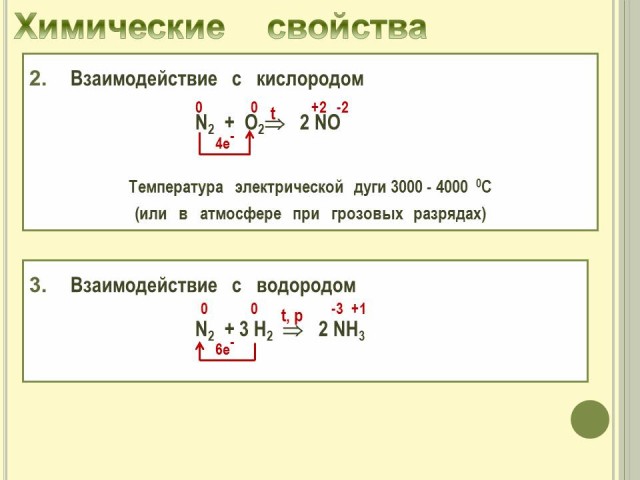
6. Химические свойства азота.
Рассматриваем химические свойства азота как окислителя. (Слайд № 8, 9).
- Взаимодействие с металлами
- Взаимодействие с водородом
- Определяем химические возможности азота как восстановителя. (Слайд № 9).
- Взаимодействие с кислородом.
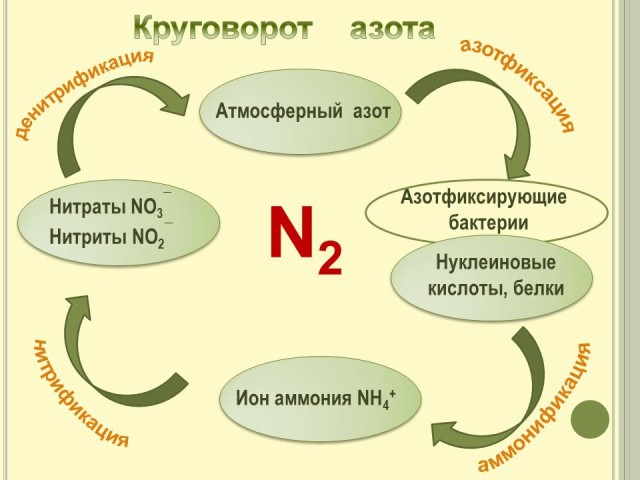
7. Круговорот азота в природе. (Слайд № 10).
Рассказ о круговороте азота в природе с использованием схемы на слайде.
IV. Заключение
- Каково положение азота в периодической системе Д.И. Менделеева?
- Какие степени окисления возможны у атома азота?
- В чём проявляется окислительно-восстановительная двойственность азота?
V. Домашнее задание
- Учебник “Химия-9” И.И Новошинский, Н.С. Новошинская, параграф 22, стр. 104, № 1 – 3.