УЭ – Учебный элемент
УЭ0 – Интегрирующая цель
УЭ1 – Входной контроль: проверка знаний о понятиях “количество вещества”, “моль”, “молярная масса”, “молярный объем”, “число Авогадро”, “стандартный вид числа”, правила действий со степенями с целым показателем.
УЭ2 – Расчеты, связанные с вычислением массы, объема, количества вещества, числа структурных частиц.
УЭ3 – Применение полученных знаний в нестандартных условиях
УЭ4 - Экспериментальная деятельность: сравнение количества вещества частиц в простом и сложном веществе
УЭ5 – Подведение итогов. Рефлексия.
| УЭ | Учебный материал с указанием заданий | Указания к выполнению работы | |||||||||||||||||||||||||||
| УЭ0 | Интегрирующая цель: 1. Систематизировать разные способы решения задач, реализуя межпредметные связи курсов: химия, математика. 2. Знать понятия: количество вещества, моль, молярная масса, число Авогадро, молярный объем, стандартный вид числа. 3.Уметь вычислять количество вещества, число структурных частиц вещества, молярную массу и объем любого газообразного вещества, стандартный вид числа, правила действий со степенями с целым показателем. 4. Способствовать развитию умений творческого подхода к решению практических задач, выполнение теста, участие в дидактических играх, обеспечить высокую творческую активность при выполнении экспериментальной работы. 5. Содействовать развитию умений применять полученные знания в нестандартных условиях, создать условия для развития познавательного интереса к предметам химия-алгебра и к процессу приобретения знаний в целом, формированию навыков работы в группах и самостоятельности каждого из них, развитию логического мышления, уверенности в своих силах. Условия работы: 1) стремление к цели; 2) относительно мягкий контроль; 3) успех рождает доверие. |
На доске: “КОЛИЧЕСТВЕННЫЕ СООТНОШЕНИЯ. СТАНДАРТНЫЙ ВИД ЧИСЛА” На столах учащихся: рабочая карта учащегося, модуль урока; разновесы, железный гвоздь, мел, химическая ложка. |
|||||||||||||||||||||||||||
| УЭ1 | Цель: проверить усвоения ранее
изученных понятий по химии и алгебре. Задание 1 (для всех) 1. Дать определение понятия “химия”. 2. Что такое стандартный вид числа? 3. В чем измеряется количество вещества? 4. Сформулируйте правило умножения степеней с целым показателем. 5. Какую массу называют молярной массой? 6. Сформулируйте правило деления степеней с целым показателем. 7. Объясните понятие “постоянная Авогадро”? 8. Сформулируйте правило возведения степени с целым показателем в степень. |
ВРЕМЯ РАБОТЫ - 3 мин. Блиц-опрос (фронтальная работа) См. слайд |
|||||||||||||||||||||||||||
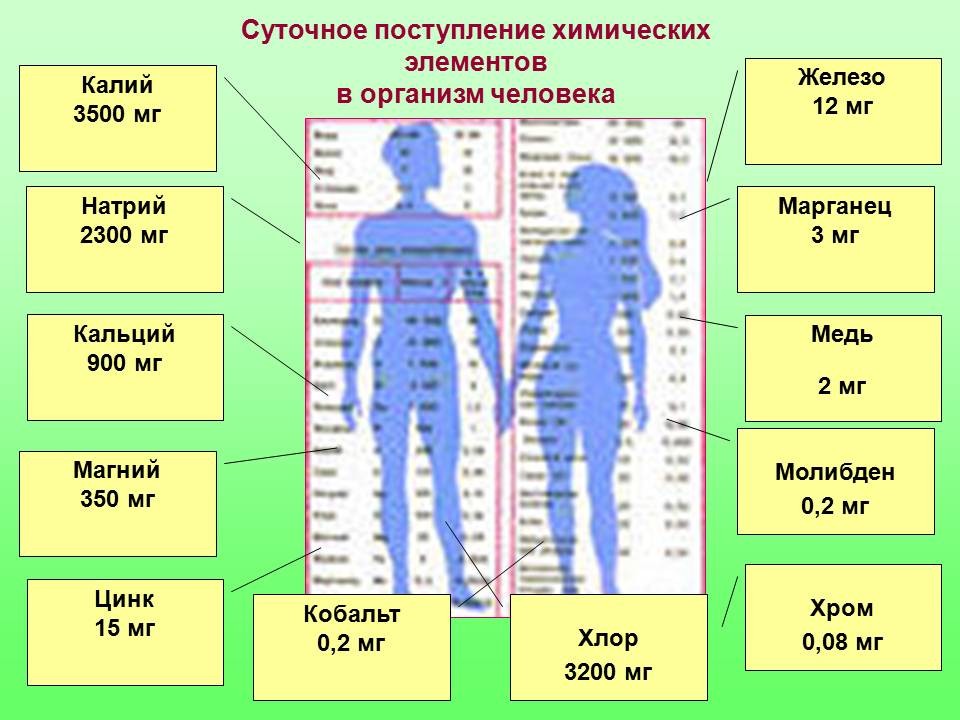
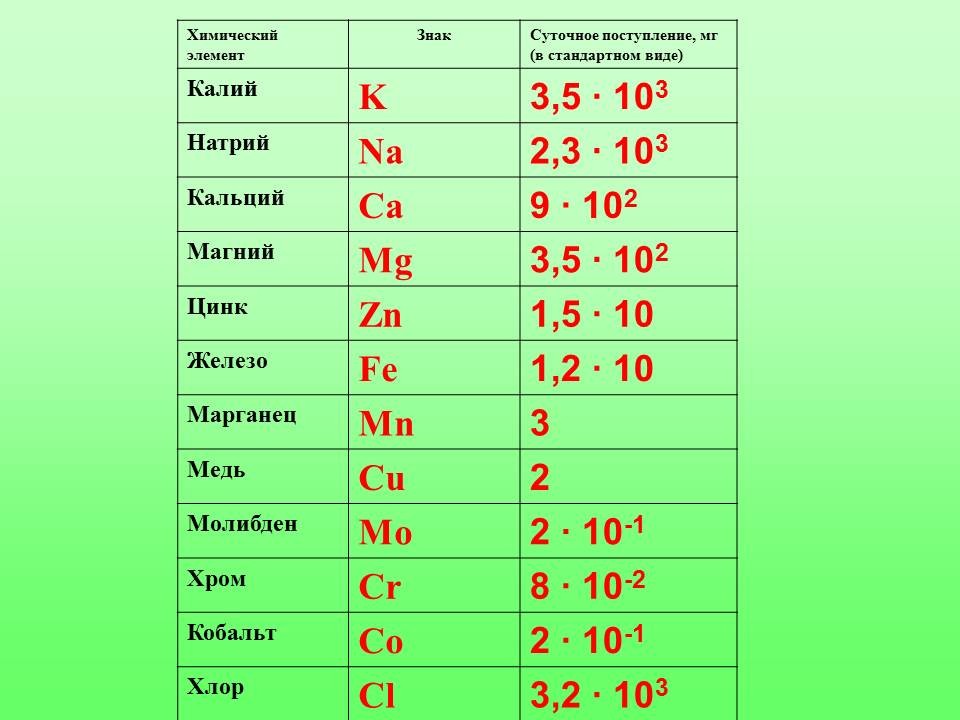
| Задание 2 (для всех) Заполните таблицу “Суточное поступление химических элементов в организм человека” |
ВРЕМЯ РАБОТЫ – 3 мин. Заполнение таблицы
– в РАБОЧЕЙ КАРТЕ УЧАЩЕГОСЯ. За правильное выполнение задания -1 балл по каждому из предметов в бланк для подведения итогов. |
||||||||||||||||||||||||||||
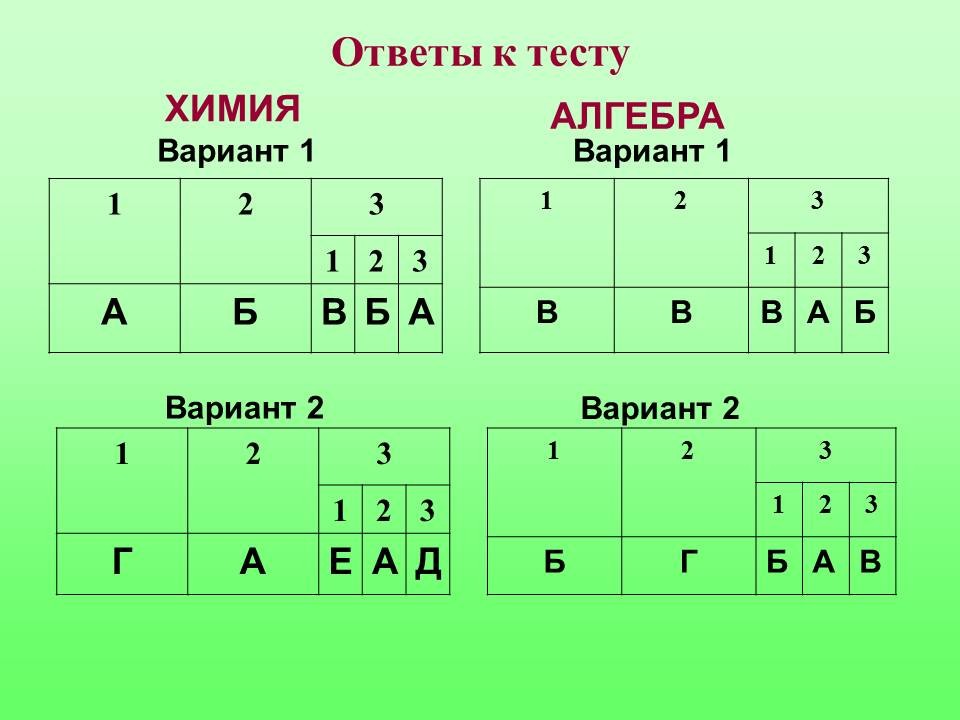
| Задание 3 (по вариантам) Тестовые задания с выбором одного правильного ответа и на соответствие 1 вариант Химия 1. Выберите значение молярного объема газов (н.у.): А) 22,4 Б) 0 В) 1 Г) 6·1023. 2. По какой формуле можно рассчитать массу вещества, если известны его количество и химическая формула? А) m = 3. Соотнесите: названия величин:
Алгебра 1. Выберите выражение, равное выражению 102: А) 100 * 10-4 Б) 108 * 10-4 В) 10-6:10-8 Г) (10-3)5. 2. Выразите 121 т в граммах и запишите ответ в стандартном виде: А) 12,1 * 107 Б) 1,2 * 108 В) 1,21 * 108 Б) 1,21 * 107. 3. Установите соответствие между числами и их стандартным видом 1) 3850 А) 3,85 * 10-1 2) 0,385 Б) 3,85 * 10 3) 38,5 В) 3,85 * 103 Г) 3,85 * 102. 2 вариант Химия 1. Выберите значение молярного объема (при н.у.): А) 6*1023 Б) 101,3 В) 273 Г) 22,4. 2. По какой формуле можно рассчитать объем вещества, если известны его количество? А) V = Vm* n Б) m= M*n В) V= 3. Соотнесите: названия величин:
|
ВРЕМЯ РАБОТЫ - 4 мин.
Внести ответы по предмету в РАБОЧУЮ КАРТУ УЧАЩЕГОСЯ. |
||||||||||||||||||||||||||||
| Алгебра 1. Выберите выражение, равное выражению 103: А) 1000 * 10-6 Б) 109 * 10-6 В) 10-6:10-3 Г) (10-3)6. 2. Выразите 341 кг в граммах и запишите ответ в стандартном виде: А) 34,1 * 104 Б) 3,4 * 103 В) 3,41 * 103 Г) 3,41 * 105 3. Установите соответствие между числами и их стандартным видом 1) 57,6 А) 5,76 * 103 2) 5760 Б) 5,76 * 10 3) 0,576 В) 5,76 * 10-1 Г) 5,76 * 102 |
% Самоконтроль: сверить ответы (см. слайд) “3 балла” - нет ошибок; “2 балла” - одна ошибка. “1 балл” - две ошибки Выставление баллов по предметам в бланк для подведения итогов. |
||||||||||||||||||||||||||||
| УЭ2 | Цель: закрепить умения решать
расчетные задачи с использованием изученных
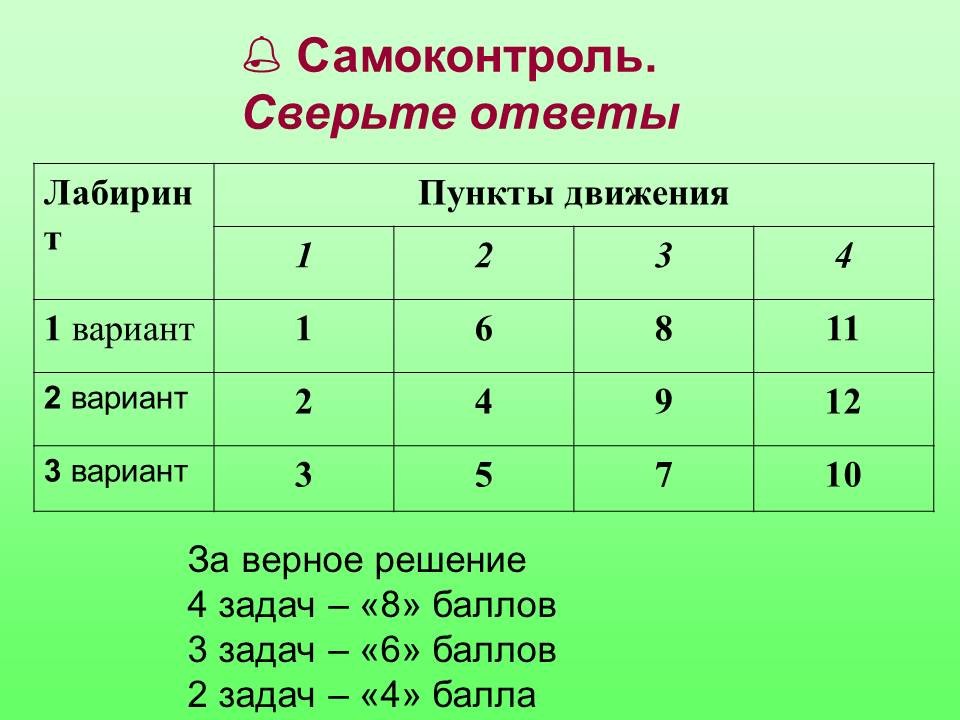
формул и понятий. Задание Перед вами лабиринт, состоящий из задач по химии и математике разной сложности. Сейчас вы самостоятельно выберите путь, по которому будете двигаться от задачи к задаче. Правильно решая задачу, вы будете продвигаться в определенной последовательности от одного задания к другому. Номер пути совпадает с номером первого задания. Чтобы дойти до пункта назначения, нужно выполнить четыре задачи. Если у вас что–то не получилось или вы сбились с пути, обратитесь к учителю. Приятного пути! |
ВРЕМЯ РАБОТЫ -12 мин. | |||||||||||||||||||||||||||
| 1. Масса атмосферы Земли 5,15 * 1015 т.
Кислород составляет 20% массы атмосферы. Сколько
кислорода в атмосфере Земли? Сумма цифр показателя - № вашего следующего пункта 2. Какова масса атома водорода, если 2 г водорода содержат 6,02 * 1023 молекул (в одной молекуле водорода содержится два атома)? Последняя цифра показателя - № вашего следующего пункта. 3. Масса атмосферы Земли 5,15 * 1015 т. Азот составляет примерно 80% массы атмосферы. Сколько азота в атмосфере Земли? Последняя цифра показателя - № вашего следующего пункта. 4. Сколько граммов весит 1,93 * 1023 атомов кремния. Округленная масса кремния - № вашего следующего пункта. 5. Сколько молекул содержится в 21 г воды Н2О? Первая цифра ответа - № вашего следующего пункта. 6. Рассчитайте массу серы количеством 0,25 моль. Масса серы - № вашего следующего пункта. 7. Какова масса 11,2 л неона (н.у.)? Масса неона - № вашего следующего пункта. 8. Рассчитайте объем хлора количеством 0,5 моль. Число, составленное двумя первыми цифрами ответа - № вашего следующего пункта. 9. Сколько молекул содержится в 44,8 л фтора? Первая цифра в ответе - № вашего следующего пункта. 10. В атомной физике за единицу массы принята атомная единица массы (обозначается а.е.м.).1а.е.м.=1,66 * 10-24г. Выразите в граммах массу одного атома гелия, зная, что масса атома гелия равна 3, 016 а.е.м. Если вы решили эту задачу, значит, вы дошли до пункта назначения. Поздравляем! 11. В атомной физике за единицу массы принята атомная единица массы (обозначается а.е.м.).1а.е.м.=1,66 * 10-24г. Выразите в граммах массу одного атома алюминия, зная, что масса атома алюминия равна 29, 99 а.е.м. Если вы решили эту задачу, значит, вы дошли до пункта назначения. Поздравляем! 12. В атомной физике за единицу массы принята атомная единица массы (обозначается а.е.м.).1а.е.м.=1,66 * 10-24г. Выразите в граммах массу одного атома свинца, зная, что масса атома свинца равна 205, 97 а.е.м. Если вы решили эту задачу, значит, вы дошли до пункта назначения. Поздравляем! |
Вариант 1: начало пути с №1; Вариант 2: начало пути с № 2; Вариант 3 – начало пути с № 3.
Краткое решение задач в РАБОЧЕЙ КАРТЕ УЧАЩЕГОСЯ.
% Самоконтроль: сверить ответы (см. слайд) За верное решение: 4 задач – “8” баллов 3 задач – “6” баллов 2 задач – “4” балла |
||||||||||||||||||||||||||||
| Зарядка для глаз. | (См. слайд) | ||||||||||||||||||||||||||||
| УЭ3 | Цель: содействовать развитию умений
применять полученные знания в нестандартных
условиях. 1. Игра “Крестики-нолики” А) Выигрышный путь составляет размерность величины - количество вещества:
Б) Выигрышный путь составляют формулы, по которым можно рассчитать число структурных частиц:
В) Выигрышный путь составляют выражения, значения которых равны 100:
2. Игра “Третий лишний” А) Подберите синонимическое выражение к понятию “молярная масса вещества”: 1. это отношение массы вещества к молярной массе; 2. это масса одной молекулы вещества; 3. это масса 6 *1023 молекул вещества. Б) Подберите синонимическое выражение к понятию “молярный объем газообразных веществ”: 1. это отношение количества вещества к его объему; 2. отношение объема газообразного вещества к его количеству; 3. объем одной молекулы газообразного вещества. |
ВРЕМЯ РАБОТЫ - 3 мин. Фронтальная работа в классе |
|||||||||||||||||||||||||||
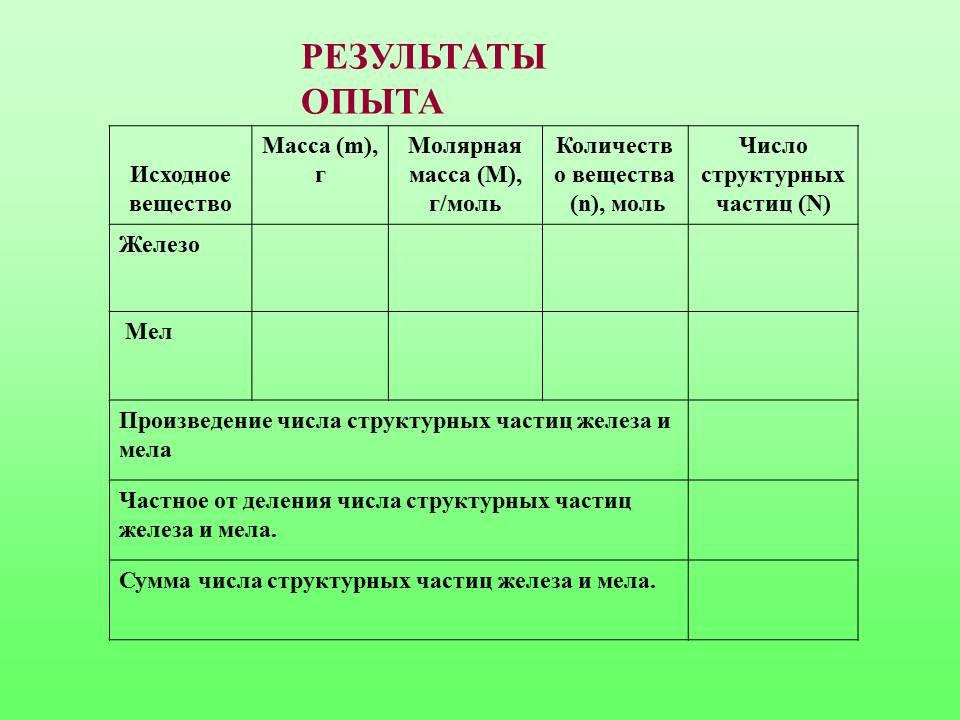
| УЭ4 | Цель: научиться определять число
структурных частиц вещества взвешиванием. Оборудование и реактивы: весы с разновесами, ложка, железный гвоздь, порошок мела. Проблема: можно ли сосчитать число структурных единиц веществ взвешиванием? - Внимательно изучи инструкцию: 1. Положите железный гвоздь на одну чашку весов. 2. Уравновесьте гвоздь разновесами. 3. Запишите значение массы гвоздя в таблицу. 4. Снимите разновесы с чашки весов. 5. Насыпьте порошок мела на свободную чашку весов до равновесия. 6. Запишите массу мела в таблицу. 7. Рассчитайте количество вещества атомов железа в гвозде и карбоната кальция СаСО3 в порошке мела. 8. Вычислите число структурных частиц железа и карбоната кальция. 9. Заполните таблицу. 10. Найти произведение числа структурных частиц железа и мела. 11. Найти частное от деления числа структурных частиц железа и мела. 12. Найти сумму числа структурных частиц железа и мела. 13. Приведите в порядок рабочее место. |
ВРЕМЯ РАБОТЫ - 12 мин.
Работа в парах. Заполнение учащимися таблицы в РАБОЧЕЙ КАРТЕ УЧАЩЕГОСЯ по ходу выполнения экспериментальной деятельности.
Учащиеся анализируют результаты опытов, выделяют главное, выполняют расчеты. |
|||||||||||||||||||||||||||
| УЭ5 | Цель: установить факт
достижения цели урока и зафиксировать конечный
результат. 1. Подведите подсчет баллов в рабочей карте урока. 2. Выберите в Рабочей карте предложение, соответствующее Вашему уровню знаний и умений. Спасибо за работу на уроке! |
ВРЕМЯ РАБОТЫ - 2 мин. Подсчет баллов и выставление отметки по каждому предмету в РАБОЧЕЙ КАРТЕ УЧАЩЕГОСЯ |