Задачи урока:
Образовательные: сформировать у учащихся понятие о строении и функциях белков.
Воспитательные.
Формировать умение строить ответ с использование дополнительного материала, выделять общее и особенное при использовании нескольких источников информации, делать выводы.
Развивающие.
Развивать познавательный интерес и способности учащихся.
Оборудование. Слайд-презентация.
План урока
- Организационный момент.
- Актуализация знаний.
- Изучение нового материала.
- Закрепление изученного материала.
- Задание на дом.
3.1 История открытия белков
3.2 Строение белков
3.3. Функции белков
А) Решение кроссворда
Б) Опорный конспект
Ход урока
Этап урока |
Деятельность учителя |
Деятельность ученика |
1. Организационный момент. |
Приветствие, проверка присутствующих на уроке. | Настрой на урок. |
2. Актуализация полученных знаний по теме “Углеводы. Липиды” |
Проверка качества усвоения предыдущей темы “Углеводы. Липиды”. | Два ученика рисуют опорный конспект на доске по темам “Углеводы”, “Липиды”, остальные работают с тестом. |
3. Изучение нового материала. |
Слайд 1. Как Вы понимаете слова Ф. Энгельса: “Повсюду, где мы встречаем жизнь, она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явление жизни”? |
Ученики высказывают предположение о том, что в органические вещества, к которым относится белок, являются основой живых существ. |
| Слайд 2 Сегодня мы продолжим изучение органических веществ. Думаю, что вы уже догадались, что сегодня мы с вами будем изучать строение и функции белков. Что бы Вы хотели узнать о белках? Какие задачи мы ставим перед собой? (записывает вслед за учениками на доске) |
Ученики формулируют задачи на урок. | |
| 3.1. История открытия белков (работа при помощи слайд-презентации) | Как формировались знания о строении
белка? (Примерное изложение истории открытия белков в приложении к уроку) |
Учитель или ученик, получивший
опережающее задание рассказывает об истории
изучения химической природы белка, сопровождая
рассказ слайд-презентацией. Учащиеся делают краткие записи в тетрадях. |
| 3.2.Строение белков | Слайд 3. Белки – наиболее
важный компонент живой материи, это –
биополимеры, построенные из остатков Элементарный состав белков. а) С (углерод) – 50-55%; О (кислород) –
21-24%; N (азот) – 15-17% ( Азот – это постоянный компонент белков и по его количеству можно определить содержание белка в тканях. б) содержание белков в органах человека составляет в среднем 18-20% сырой массы ткани. В пересчете на сухой остаток – мышцы – до 80%, сердце – 60%, печень – 72%, легкие, селезенка – 82 – 84%. Слайд 4. Белки – это высокомолекулярные соединения (полимеры), состоящие из a-аминокислот – мономерных звеньев, соединенных между собой пептидными связями. В состав большинства белков входят 20 разных аминокислот из 170 известных. Все 20 аминокислот, встречающиеся в белках, это a -аминокислоты, общим признаком которых является наличие аминогруппы – NН2 и карбоксильной группы – СООН у a-углеродного атома. a-аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Радикалов 20, поэтому аминокислот тоже 20, их назвали “магическими” или волшебными, так как из них можно построить бесконечное множество белков. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков. |
Ученики работают в тетрадях, отмечая наиболее значимые моменты темы. |
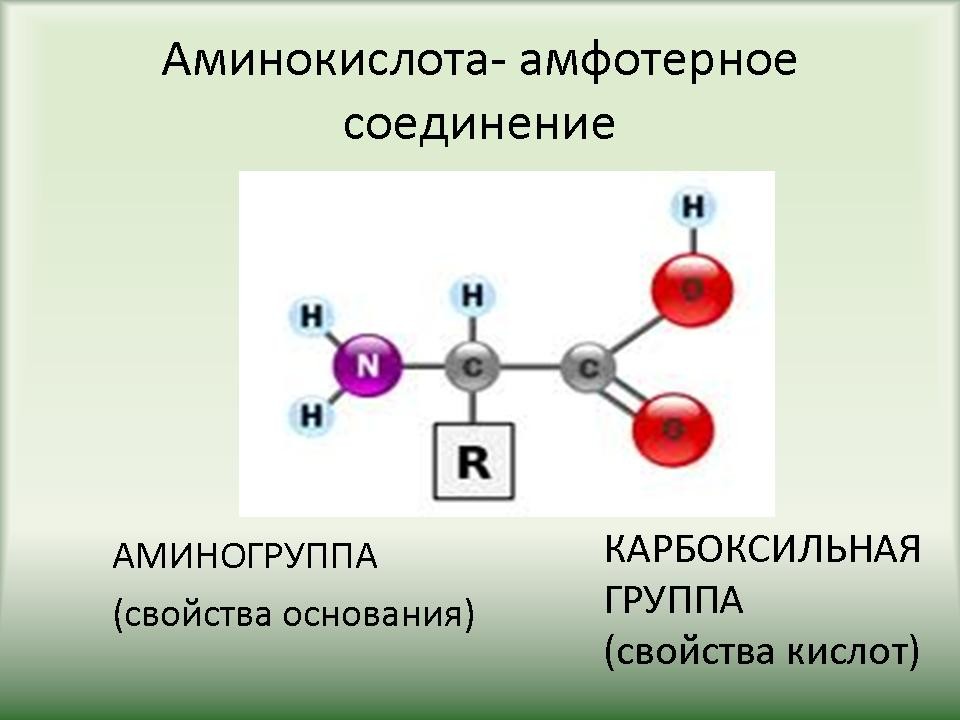
| Слайд 5. Молекула аминокислоты состоит из специфической части (радикала R) и части, одинаковой для всех аминокислот, включающей аминогруппу (— NH2) с основными свойствами, и карбоксильную группу (СООН) с кислотными свойствами. Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность, поэтому аминокислота – амфотерное соединение. Через эти группы происходит соединение аминокислот при образовании полимера — белка. При этом из аминогруппы одной аминокислоты и карбоксила другой выделяется молекула воды, а освободившиеся электроны соединяются, образуя пептидную связь. Поэтому белки называют полипептидами. | ||
| Слайд 6. Заменимые и незаменимые
аминокислоты Незаменимые. Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. Заменимые. Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин, тирозин. Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей. |
||
| Слайд 7. Содержание незаменимых
аминокислот. Аминокислоты – это органические соединения, являющиеся строительным материалом для белков и мышечных тканей. В организме человека аминокислоты выполняют много важных функций. Помимо воспроизводства ферментов (включая пищевые ферменты), аминокислоты играют важную роль в нашем организме, отвечая за нормализацию настроения, концентрации, агрессии, внимания, сна, а также и сексуальной активности. Поступая в организм, потребленный белок разрушается на аминокислоты. Затем, отдельные аминокислоты используются для создания необходимых организму белков и ферментов. В свою очередь, пищеварительные ферменты помогают в усвоении белка и расщеплении его на аминокислоты, потребляемые человеком. Незаменимые аминокислоты – аминокислоты, которые не воспроизводятся нашим организмом, однако, являясь жизненно необходимыми, поступают в наш организм с пищей, богатой белками, либо с пищевыми добавками. Например: Валин содержится в зерновых, мясе, грибах, молочных продуктах, арахисе, сое Изолейцин содержится в миндале, кешью, курином мясе, турецком горохе (нут), яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое. Лейцин содержится в мясе, рыбе, буром рисе, орехах, большинстве семян. Лизин содержится в рыбе, мясе, молочных продуктах, пшенице, орехах, но больше всего его содержится в амаранте. Метионин содержится в молоке, мясе, рыбе, яйцах, бобах, фасоли, чечевице |
||
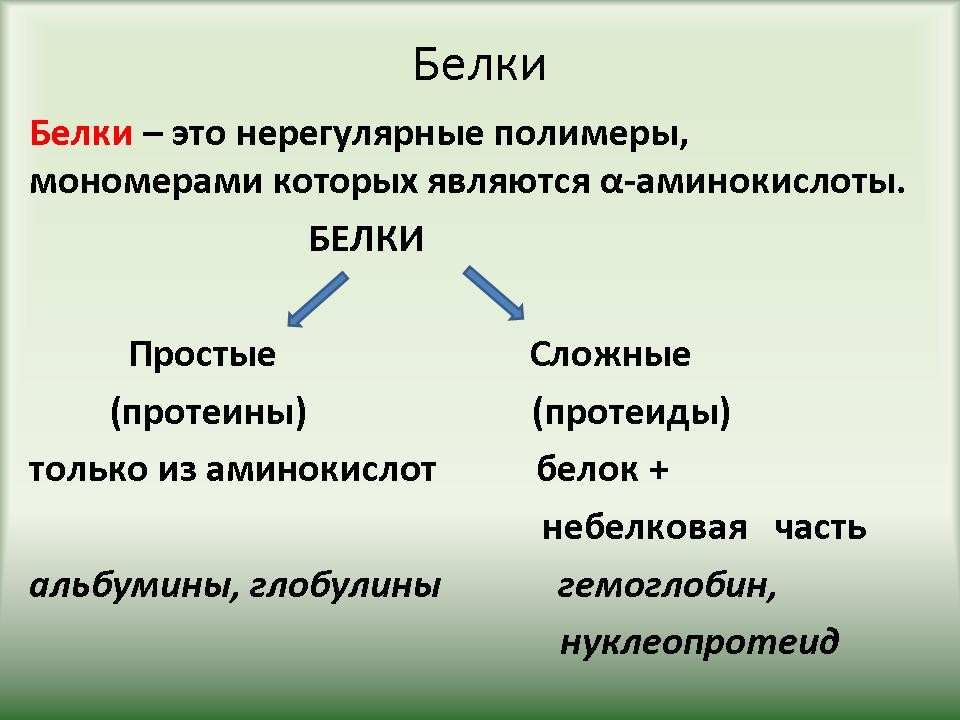
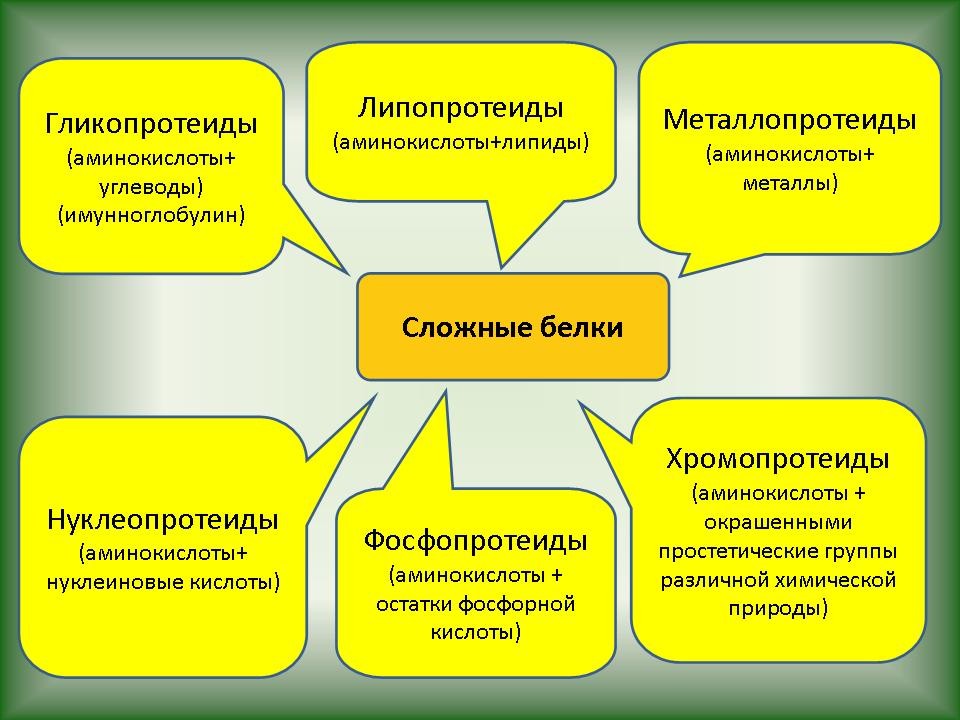
| Слайд 8. По структуре белки делят на простые и сложные. Простые белки состоят только из аминокислот. В состав сложных белков входит небелковый компонент, название которого включается в название сложного белка. Это нуклеопротеины, липопротеины, гликопротеины, металопротеины, фосфопротеины, хромопротеины (окрашенные белки), дикомпонентные ферменты. |
||
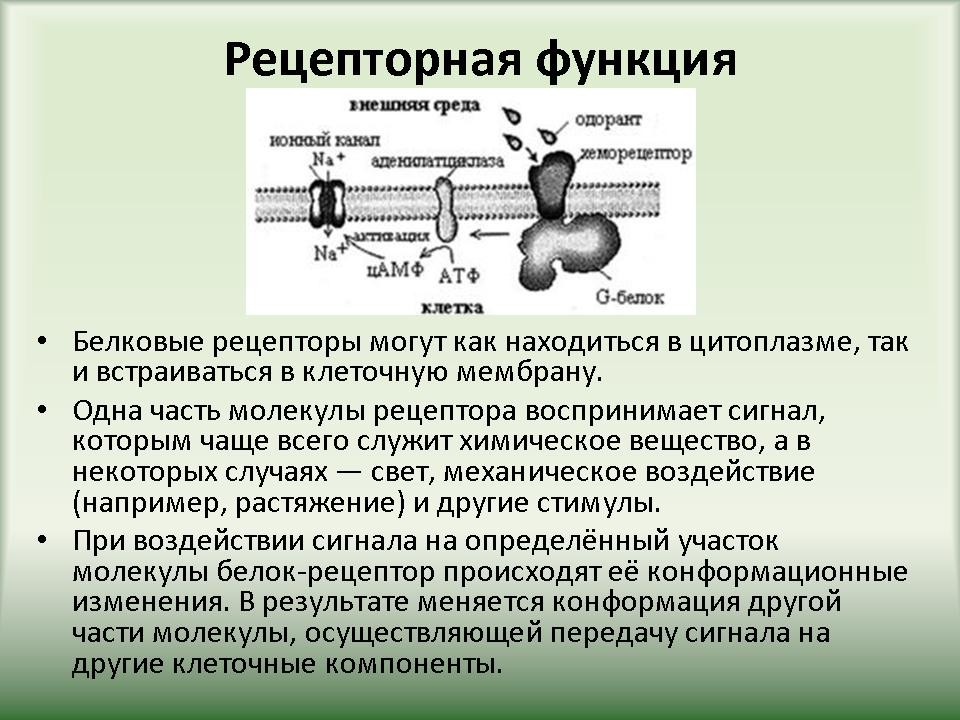
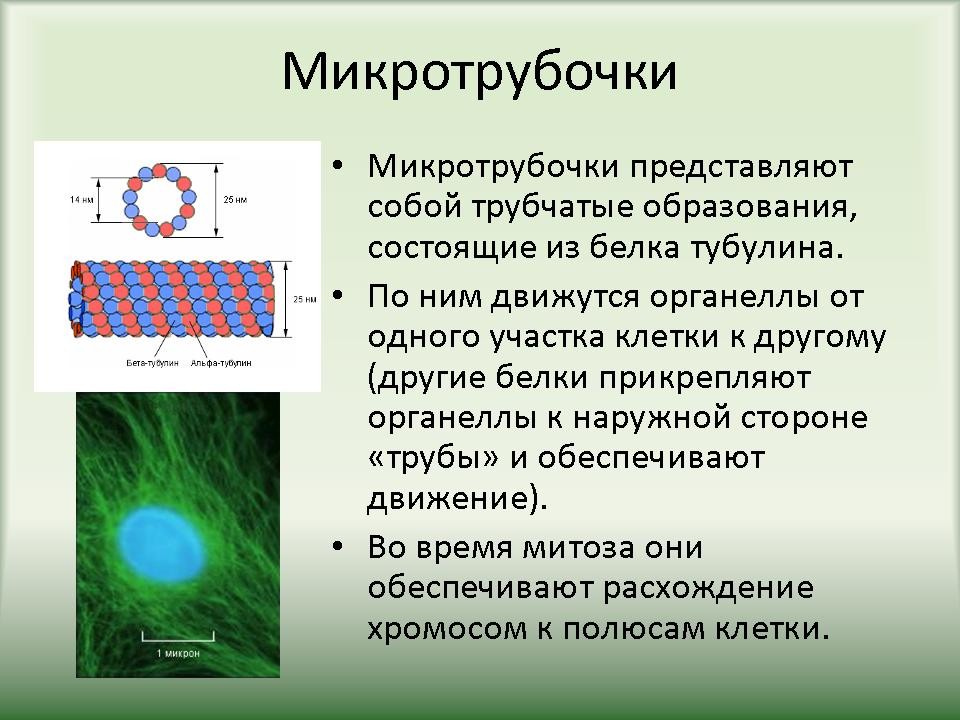
| Слайд 10. Сложные белки По общему типу строения белки можно разбить на три группы: Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортеры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала. |
||
| Слайд 11-12. Денатурация белка. Денатурация белков – это потеря белками их биологических свойств (каталитических, транспортных и т.д.) вследствие изменения структуры белковой молекулы. Денатурацию вызывают физические факторы (высокая температура, ионизирующее излучение), химические факторы (концентрированные кислоты, щелочи, реакционно-активные соединения, тяжелые металлы ). 1. Обратимая – после устранения воздействия денатурирующего агента белок восстанавливает свою активность (произошла ренатурация). 2. Необратимая денатурация (происходит необратимое нарушение первичной структуры белка). Как правило, денатурация имеет необратимый характер. Однако на первых стадиях, в условиях прекращения действия негативных факторов, белок может восстанавливать свое нормальное состояние (ренатурации). |
||
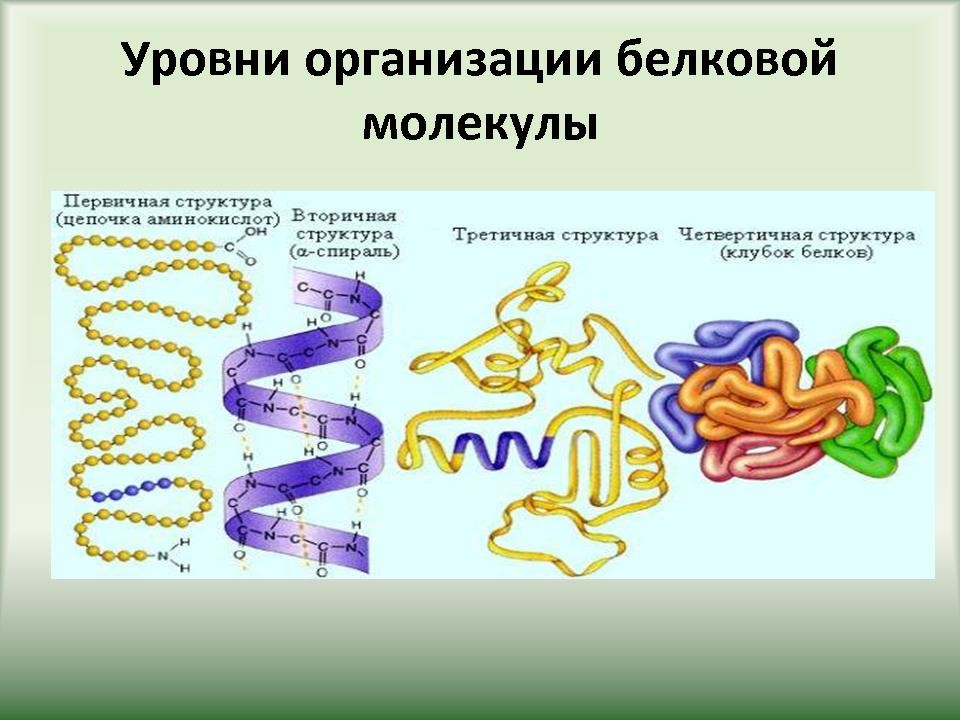
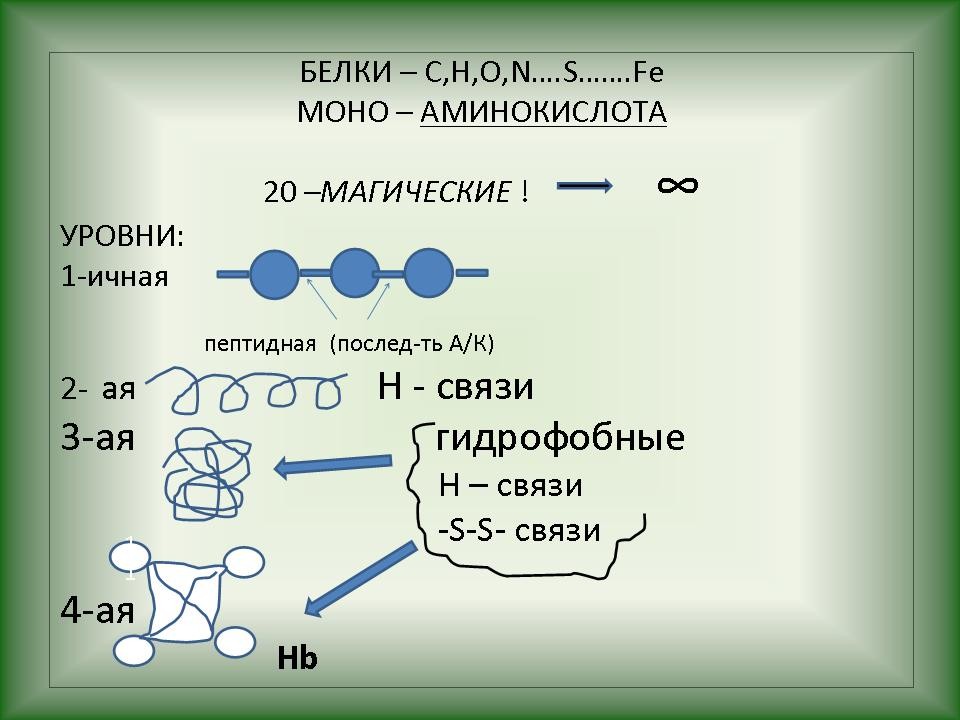
Слайд 13-14. Функциональные свойства белков также обусловлены последовательностью аминокислотных остатков и пространственной структурой (конфигурацией) полипептидной цепи. Существуют четыре уровня структурной организации белков: первичный, вторичный, третичный и четвертичный. |
Ученики по ходу рассказа заполняют таблицу “Строение белка”. | |
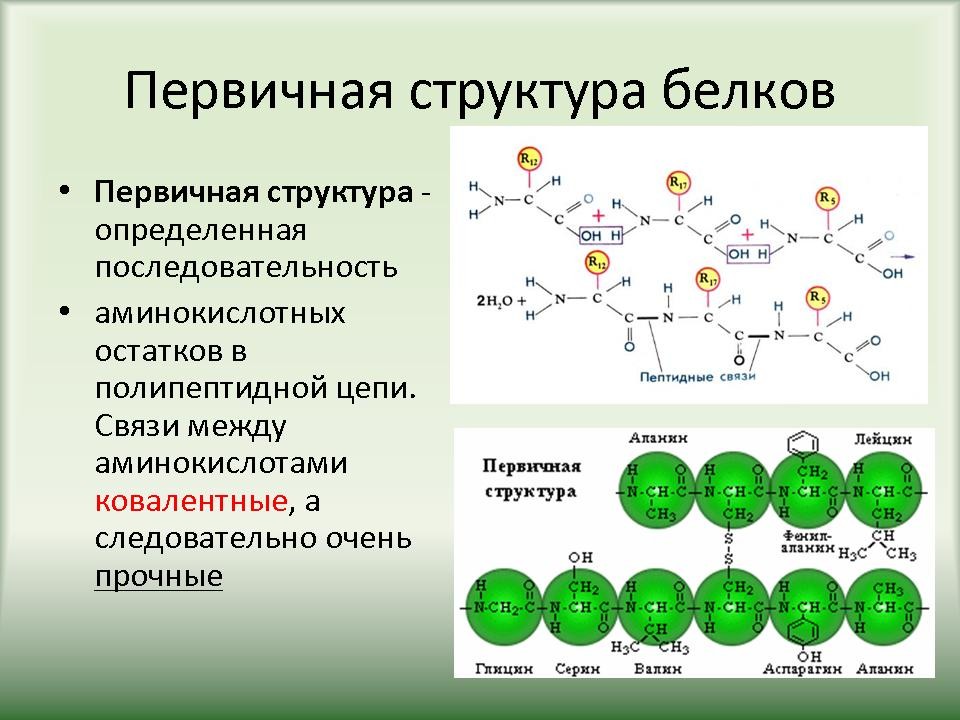
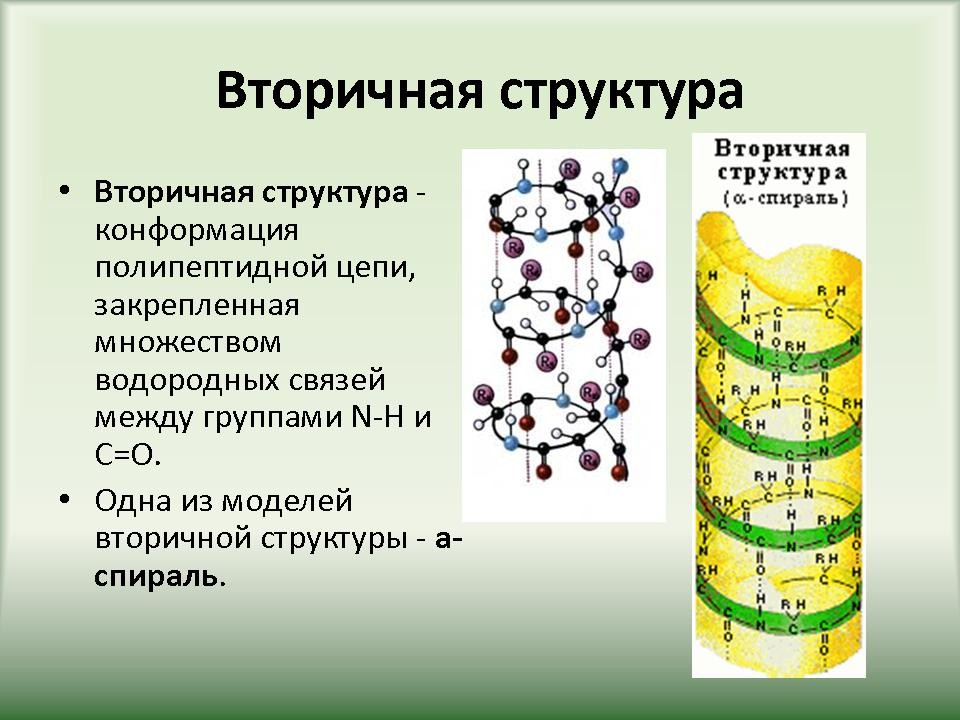
Слайд 15-20. Первичная структура белков определяется качественным и количественным составом аминокислот, а также их последовательностью. В основе образования первичной структуры лежат пептидные связи. Вторичная структура характеризует
пространственную форму белковой молекулы,
которая зачастую полностью или частично
закручивается в спираль. Аминокислотные
радикалы (R-группы) остаются при этом снаружи
спирали. В стабилизации вторичной структуры
важную роль играют водородные связи, возникающие
между атомами водорода NH-группы одного завитка
спирали и кислорода СО-группы другой и
направлены вдоль спирали. Хотя эти связи
значительно слабее пептидные, однако вместе они
формируют достаточно прочную структуру.
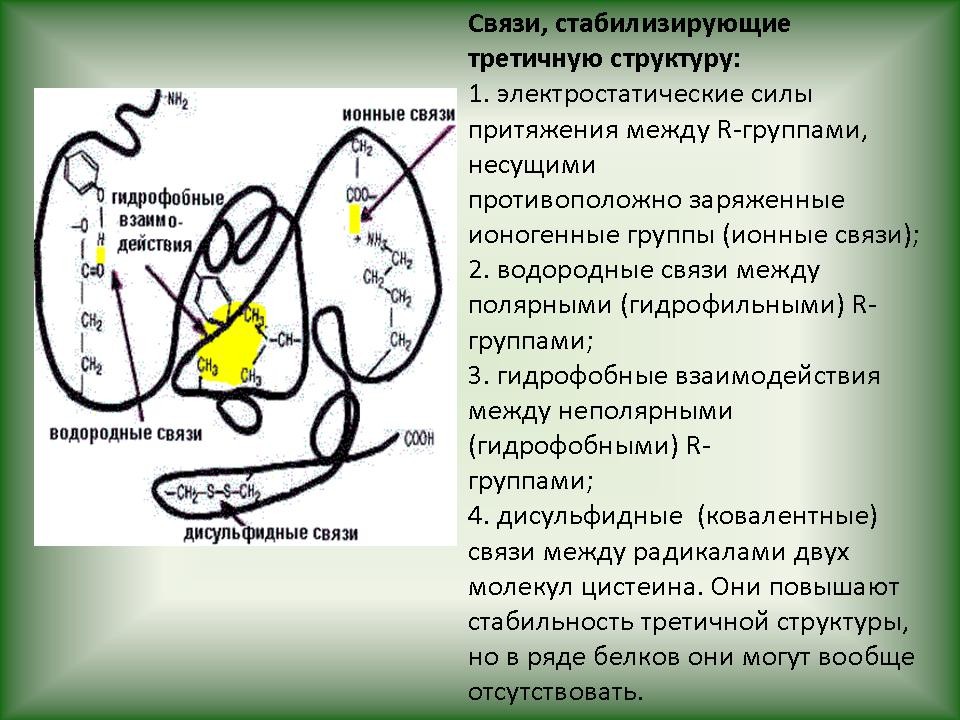
Выделяют Третичная структура отражает способность полипептидной спирали заключаться, закручиваясь определенным образом. Для каждого белка эта структура постоянна и своеобразная. Она определяется размером, формой и полярностью R-групп, а также последовательностью аминокислотных остатков. Формирование третичной структуры приводит к возникновению конфигурации под названием глобулы и вызывается различными типами не-ковалентных взаимодействий (гидрофобных, ионных, водородных связей). Важная роль в стабилизации третичной структуры принадлежит дисульфидных связей, возникающих между остатками аминокислоты цистеина. Четвертичная структура возникает вследствие объединения отдельных полипептидных цепей, которые в совокупности составляют функциональную единицу. Стабилизация четвертичной структуры определяется гидрофобными взаимодействиями (белок при этом скручивается так, что его гидрофобные боковые цепи погружены внутрь молекулы, т.е. защищают ее от взаимодействия с водой, а боковые гидрофильные – расположены наружу), а также электростатическими и другими взаимодействиями и водородными связями. Для четвертичной структуры одних белков свойственно глобулярные размещения суб-единиц, другие белки объединяются в спиральные структуры. |
||
Слайд 21. Проверь себя |
Ученики проверяют заполненную таблицу “Структура белка”. | |
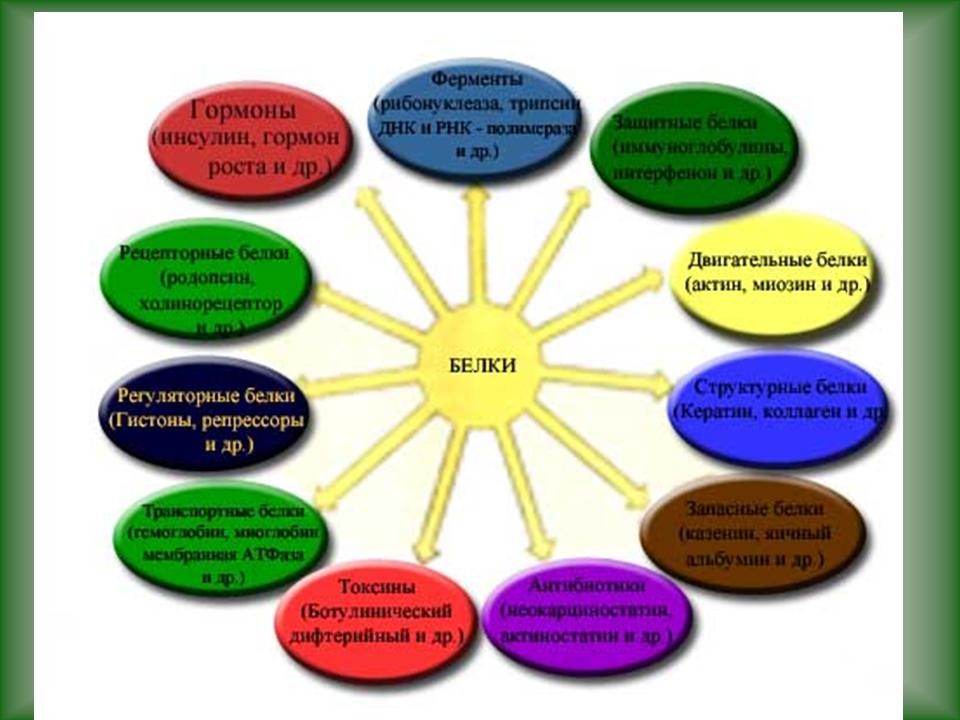
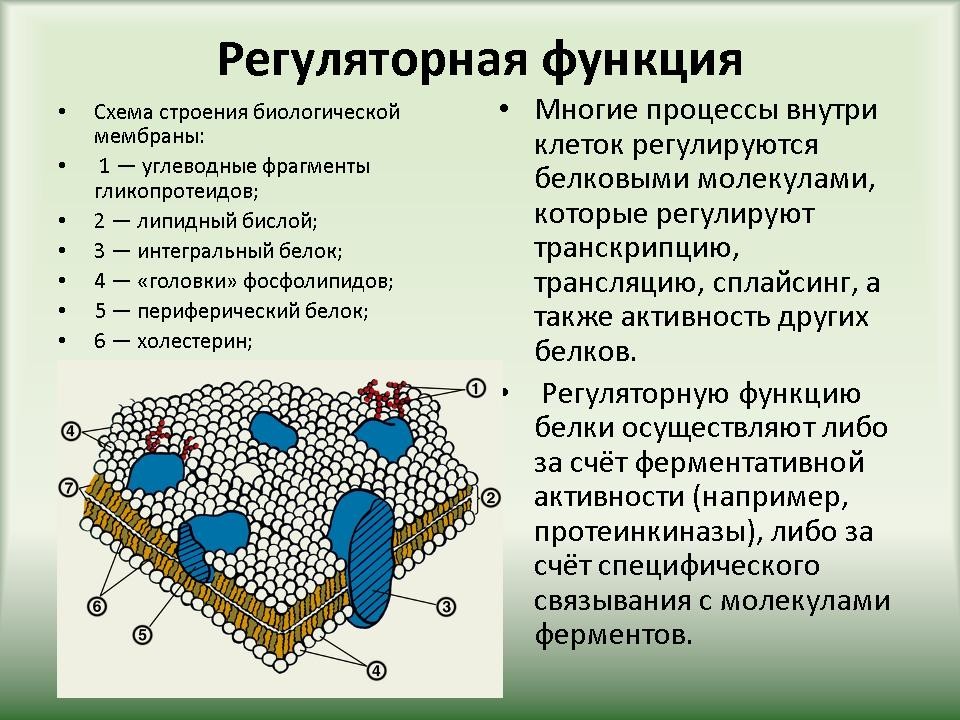
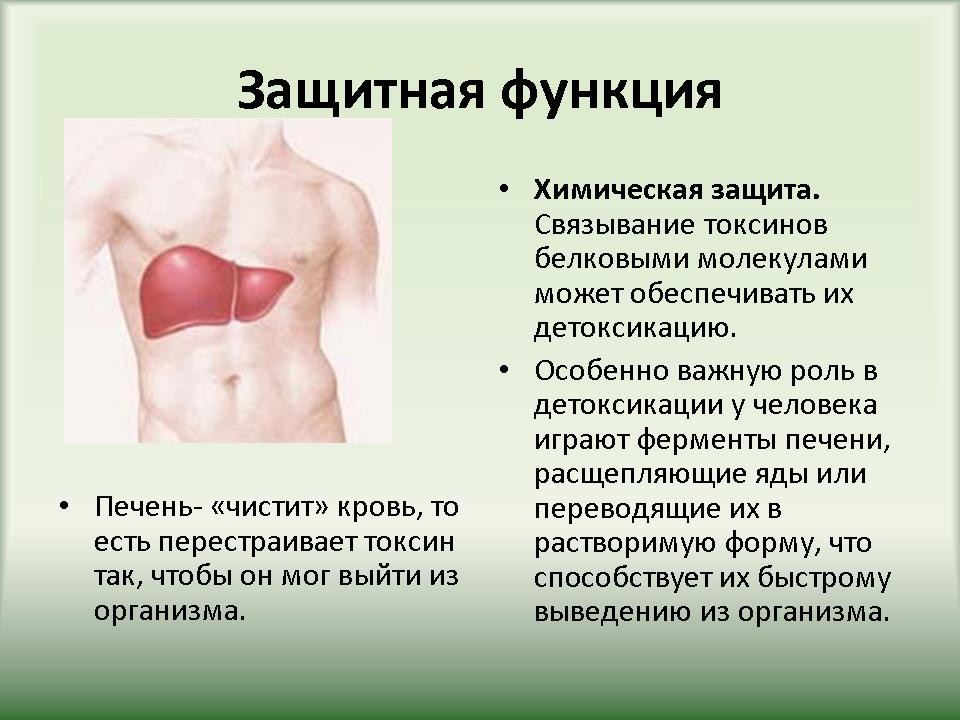
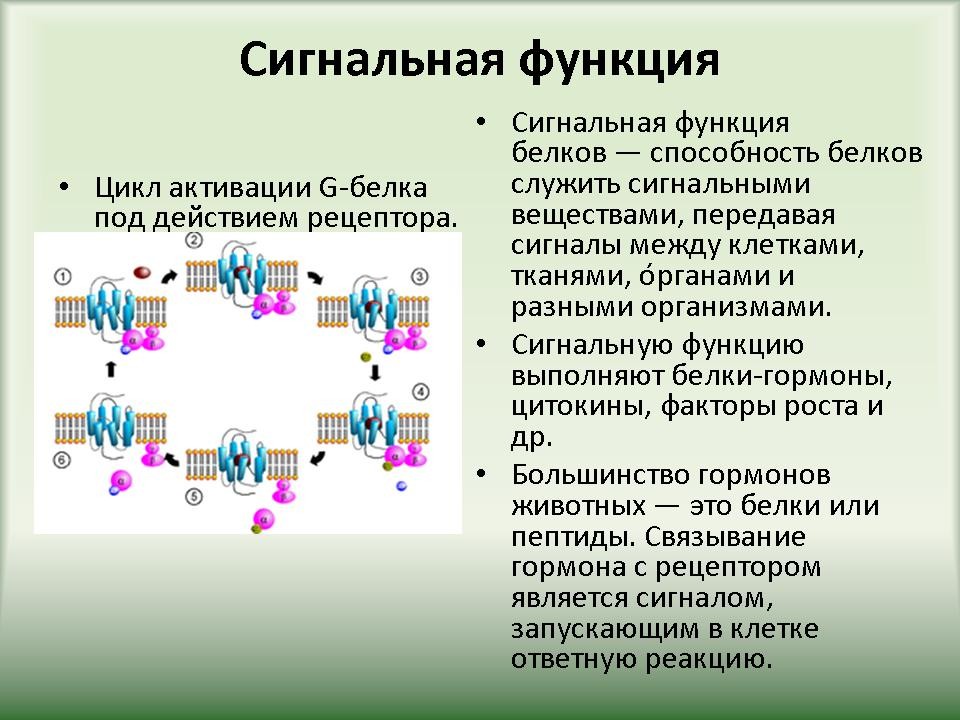
| 3.3 Функции белков | Слайд 22-39. Функции белков в организме. |
Ученики по ходу рассказа заполняют таблицу “”Функции белков”. |
4. Закрепление изученного материала. |
Слайд 40-42. Решение кроссворда по теме “Белки”. |
Ученики решают кроссворд, а затем сверяются с ответами. |
Слайд 43-45. Составление опорного конспекта |
Работают с учителем, который вычерчивает опорный конспект на доске или самостоятельно составляют опорный конспект. | |
Подводит итог: смогли ли мы сегодня решить задачи, поставленные в начале урока? |
Ученики отвечают, подводят итог, отмечают тех, кто активно участвовал в работе на уроке. | |
Теперь послушаем сообщение о наиболее интересных фактах в мире биологии по теме “Белки” |
Один из учеников проводит занимательную минутку “Это интересно”. | |
5. Задание на дом. |
Слайд 46 №3-4, ответить на вопросы в конце параграфа, дополнить примерами таблицу “Функции белков” или составить опорный конспект по теме. Творческое задание: подготовить информацию для рубрики “Это интересно” |
Записывают домашнее задание. |