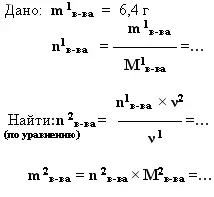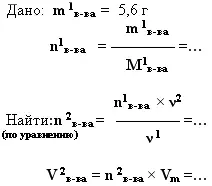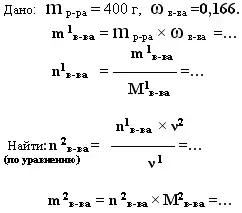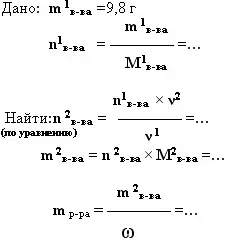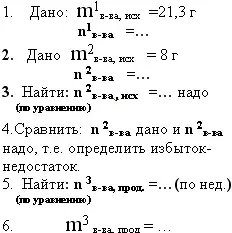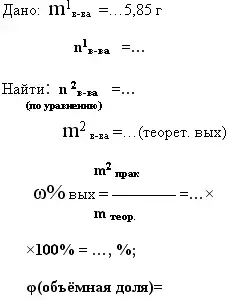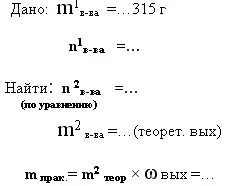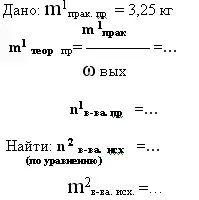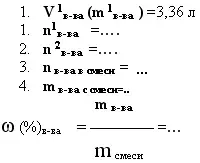Расчеты по формулам.
-
Какое из следующих соединений содержит больше железа: FeO, Fe2O3, Fe3O4.
- Сколько железа содержится в 5 моль оксида железа (III).
- Выведите формулу соединения, состоящего 88,85% из меди и 11,2% - кислорода.
- Массовое соотношение калия, углерода и кислорода в веществе - 39: 6: 24. Какова формула вещества.
- Сколько граммов воды выделится при прокаливании 644 г глауберовой соли Na2SO4*10 H2O.
- Сколько граммов кальция содержится в 250 г карбоната кальция?
|
-
*Сколько граммов кальция содержится в 300,0 г известняка, содержащего 90% карбоната кальция?
- *Минерал содержит 96% CuS. Какую массу этого минерала необходимо переработать, чтобы получить 100 г меди.
- *Из 1 т глинозёма, содержащего 95% оксида алюминия, получили 0,436 т алюминия. Каков процент выхода?
- *Сколько потребуется магнитного железняка, содержащего 90% Fe3O4 для получения 100 т железа, если потери в производстве составляют 3%.
|
Расчёты по уравнениям:
1. дано: n(моль) - найти: n(моль).
|

|
-
Сколько моль оксида меди получится при полном окислении 3 моль меди?
- Какое количества вещества гидроксида железа (III) разложилось, если получили 0,5 моль оксида железа(III)?
- Сколько моль кислорода потребуется для полного окисления 2,5 моль алюминия.
- При электролизе хлорида меди получили 3 моль меди. Сколько моль хлора при этом выделилось.
|
2. дано: m (г, кг, т) - найти: m (г, кг, т).
|
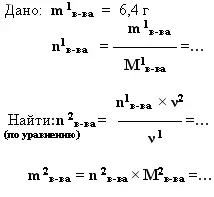
|
-
Вычислите массу оксида меди полученного при окислении 6,4 г меди.
- Сколько оксида серебра необходимо прокалить, чтобы получить10,8 г серебра.
- Какая масса гидроксида железа (III) выпадет в осадок, если на раствор, содержащий 16,25 г хлорида железа(III) подействовать раствором гидроксида натрия.
- Вычислите, достаточно ли 6,4 г кислорода для полного обжига 9,6 г сульфида цинка.
|
3. дано: m (г, кг, т) - найти:V (мл, л, м3).
|
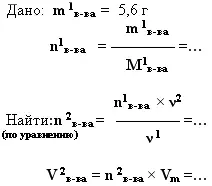
|
-
При обжиге известняка было получено 5,6 г оксида кальция. Какой объём углекислого газа(н.у.) при этом образовался.
- Какой объём хлора потребуется для полного сжигания 5,6 г железа?
- 10,6 г соды растворили в соляной кислоте. Какой объём углекислого газа при этом выделился?
- Сколько кислорода потребуется для сжигания 3 г лития?
|
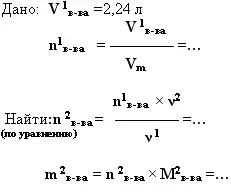
4. дано: V (мл, л, м3).- найти: m (г, кг, т)
 |
-
Цинк растворили в соляной кислоте, и объём выделившегося газа составил 2,24 л (н.у.). Какая масса цинка была растворена?
- На восстановление меди их оксида меди(II) было израсходовано 5,6 л водорода. Сколько граммов меди получили?
- Достаточно ли 2,8 л оксида углерода (II) для полного восстановления железа из 23,2 г Fe3O4. Какой объём углекислого газа при этом образуется?
|
5. дано: m р-ра(смеси) и ω (%)в-ва(примеси) - найти: mв-ва или V в-ва
|
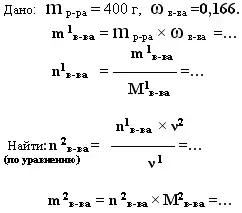
|
-
В 400 г 16,6 %-ного раствора азотной кислоты, растворили гидроксид меди(II). Какая масса соли получилась?
- Какой объём углекислого газа выделится при обжиге 120 г известняка, содержащего 5 % примесей?
- *Какая масса гидроксида алюминия выпадет в осадок при взаимодействии с раствором щелочи 150 г раствора сульфата алюминия, массовая доля соли в котором
22,8%. Какая масса гидроксида натрия должна быть в растворе щелочи.
|
6. дано: mв-ва (или V в-ва), ω (%)в-ва - найти: m р-ра
|
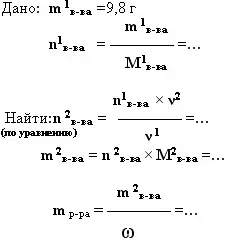
|
-
Какую массу 40% раствора гидроксида натрия необходимо взять, чтобы нейтрализовать 9,8 г серной кислоты.
- Какую массу 6%-ного раствора сульфата железа(III) необходимо взять для реакции с гидроксидом калия, чтобы получить 10,7 г гидроксида железа(III).
- Какую массу известняка содержащего 5% некарбонатных примесей, необходимо разложить, чтобы получить 44,8 л оксида углерода (IV).
- *Оксид кальция содержит 5 % карбонатных примесей. Какой объём углекислого газа выделится, если 20 г его растворить в соляной кислоте?
|
7. дано: m1в-ва и m2в-ва - исходные вещества (какое-то их них находится в избытке)
найти: m3 в-ва продукт реакции.
|
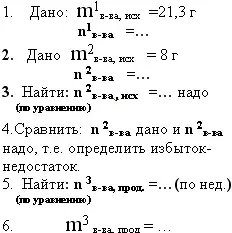
|
-
К раствору, содержащему 21,3 грамм нитрата алюминия, прилили раствор, содержащий 8 грамм гидроксида натрия, определите массу полученного осадка.
- В раствор, содержащий 40 грамм сульфата меди (2) добавили 12 грамм железных опилок, рассчитайте массу полученной меди.
- *Какой объем газа выделится, если к раствору, содержащему 53 грамма карбоната натрия, прилили 400 грамм 20 % азотной кислоты.
- *К 100 грамм 6% раствора гидроксида натрия прилили 200г 10% раствора сульфата железа (3), вычислите массу образовавшегося осадка.
|
8. дано: m1в-ва исход. и m2в-ва - продукта реакции- практический выход -
найти: m2 в-ва продукта реакции- теоретический выход. и ωвых
|
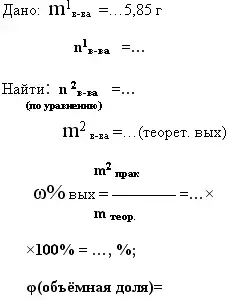
|
-
При действии концентрированной серной кислоты на кристаллический хлорид натрия массой 5,85 г было получено 2 л хлороводорода. Определите массовую
долю выхода продукта реакции в (%) от теоретически возможного.
- При взаимодействии цинка с 9,8 г серной кислоты было получено 14 г сульфата цинка. Определите массовую долю выхода продукта реакции в (%) от
теоретически возможного.
- При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н.у.). Найдите объёмную долю выхода продукта реакции.
- *Песок массой 2 кг сплавили с избытком гидроксида калия, получив в результате силикат калия массой 3,82 кг. Определите выход продукта реакции в % от
теоретически возможного, если массовая доля SiO2 в песке 90%.
|
9. дано: m1в-ва исход. и ωвых -
найти: m2 в-ва продукта реакции- практический выход
|
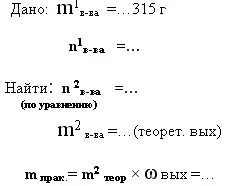
|
-
315 г азотной кислоты полностью прореагировало с гидроксидом кальция. Вычислите массу полученного нитрата кальция, если доля его выхода составляет 80% от теоретически
возможного.
- Какая масса хлорида железа(III) будет получена при сжигании 5,6 г железа в хлоре, если потери его составляют 10%?
- *Какая масса хлорида железа(III) будет получена при сжигании 5,6 г железа в 4,48 л хлора, если потери его составляют 10%?
- *Цинк массой 6,5 кг обработали 120 кг 10% раствора серной кислоты. Определите объём выделившегося газа, если выход этого продукта реакции составляет 80% от теоретически
возможного.
|
10. дано: m1 в-ва продукта реакции- практический выход и его ωвых -
найти: m2в-ва исход.
|
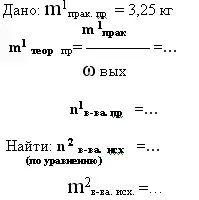
|
-
Сколько граммов сульфида меди(II) потребуется сжечь, чтобы получить 17,92 л (н.у.) оксида серы (IV), если выход продукта реакции составляет 90%?
- Хлорид железа (II) окислили хлором до хлорида железа(III), при этом получили 3,25 кг хлорида железа(III), что составляет 80% от теоретически
возможного. Какой объём хлора был израсходован на реакцию.
- *Сколько граммов медной руды, содержащей 65% сульфида меди(II) потребуется сжечь, чтобы получить 17,92 л (н.у.) оксида серы (IV), если выход продукта реакции составляет
90%?
|
11. дано: m смеси, m в-ва (или V в-ва) прод. реакции, -
найти: mв-ва и его долю - ω (%)в-ва в смеси.
А).В реакцию вступает один компонент.
|
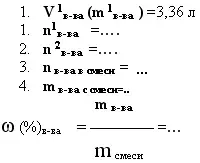
|
-
4,5 г сплава меди с магнием растворили в соляной кислоте. Объём выделившегося водорода составил 3,36 л (н.у.). Какова массовая доля магния в сплаве.
- 5 г смеси нитрата калия и хлорида калия растворили в воде и подействовали раствором нитрата серебра. Образовался осадок массой 1,5 г. Определите процентный состав смеси.
- *95,5 г смеси CuO и Fe2O3 восстановили водородом. На продукт восстановления подействовали избытком раствора соляной кислоты. Объём выделившегося водорода
составил 4,48 л. Каков процентный состав смеси.
|
- При восстановлении водородом 40 г смеси меди с оксидом меди(II) образовалось 6 г воды. Определите массовую долю (в %) каждого компонента в смеси.
- Определите массовую долю каждого компонента в смеси, образующейся в результате взаимодействия 27 г порошкообразного алюминия и 64 г оксида железа(III).
- Какая масса 20% соляной кислоты потребуется для полного растворения 10 г смеси цинка с оксидом цинка, если при этом выделился водород объёмом 2,24 л (н.у.).
- Определите массовую долю (в %) железа в сплаве с углеродом, если при обработке образца сплава массой 6 г соляной кислотой выделилось 2,24 л газа (н.у.). Какой объём соляной кислоты (ρ=
1,09г/мл) с массовой долей HCl 18,25% вступил в реакцию.
- При взаимодействии со щелочью 4,5 г сплава алюминия с магнием выделилось 3,36 л водорода (н.у.). Какова массовая доля алюминия в сплаве?
- Через известковую воду пропустили 1 л смеси оксида углерода (II) и оксида углерода(IV). Выпавший осадок отфильтровали, промыли и просушили. Его масса составила 2,45 г. Определите объёмную
долю каждого газа в исходной смеси.
- 4 г смеси кремния, алюминия и оксида магния обработали избытком соляной кислоты. Объём выделившегося газа составил 2,24 л, а масса нерастворившегося остатка составила 1,2 г. Определите
количество вещества оксида магния в смеси.
- При растворении 4,5 г оксида меди(II), загрязнённого песком, был использован 16%-ный раствор азотной кислоты объёмом 36,1 мл (ρ= 1,093г/мл). Рассчитайте массы чистого оксида меди и песка,
содержащихся в навеске.
В реакцию вступает два компонента. (Составляется 2 уравнения химических реакций и алгебраическое уравнение или система уравнений.)
- При взаимодействии смеси порошков железа и цинка массой 6,05 г с избытком раствора хлорида меди(II) образовалась металлическая медь массой 6,4 г. Определите количественный состав исходной
смеси.
- Для растворения смеси карбоната кальция и карбоната магния в воде потребовалось 2,016 г углекислого газа (н.у.) определите количественный состав смеси карбонатов.
- При взаимодействии 30,7 г смеси цинка и алюминия, в разбавленной серной кислоте выделился водород объёмом 11,2 л (н.у.). Вычислите массовую долю цинка в смеси.
- На нейтрализацию 100 г раствора, содержащего 5,7 г смеси гидроксида натрия и кальция, израсходовали 9,45 г азотной кислоты. Вычислите массовые доли (в %) солей в исходной смеси.
- * Смесь железа с оксидом железа(II) и оксидом железа (III) обработали соляной кислотой и получили 112 мл водорода. 1 г этой же смеси при восстановлении водородом даёт 0,2115 г воды.
Определите массовую долю оксида железа в смеси.