Цели урока: актуализировать, обобщить и расширить знания учащихся о водородной связи; показать биологическое значение водородной связи и действие различных факторов на водородную связь.
Оборудование: компьтер, мультимедийный проектор, презентация (Приложение 3); штатив для пробирок, пробирки, стекляная палочка.
Вещества и реактивы: вода, этиловый спирт, уксусная кислота, глицерин, азотная кислота, р-р сульфата меди, водный раствор куриного белка.
Методы и методические приемы: словесный, наглядный, демонстрационный.
Информационные источники: (Приложение 2)
Ход урока
I.Организация.
II.Проверка домашнего задания
Проверка домашенего задания проводится в форме беседы по вопросам и выполнения отдельными учащимися индивидуальных заданий.
Беседа по вопросам.
- Какими особенностями характеризуется строение атомов металлов?
- Что такое металлическая связь?
- Что представляет собой металлическая кристаллическая решетка?
- Как особенности строения металлов – простых веществ сказываются на их физических свойствах?
Индивидуальные задания.
№1. Составить схему строения и записать электронную конфигурацию атома индия. Определить, к какому семейству химических элементов принадлежит индий.
№2.Какой объем водорода выделится при взаимодействии 0,7 моль цинка с соляной кислотой ?
№3.Найти массу 0,75 моль железа.
III.Изучение нового материала.
По ходу изучения материала учащиеся формируют опорный конспект (Приложение 1).
– Мы продолжаем изучать типы химических связей. Какие типы химических связей вы уже знаете?
Предполагаемый ответ ученика.
– Ковалентная полярная, ковалентная неполярная, ионная, металлическая.
– На сегодняшнем уроке мы рассмотрим еще один вид химической связи – водородную связь. Запишите тему урока (слайд №1). Сегодня мы выясним, какие вещества образуют водородную связь, определим виды водородной связи, установим, как водородная связь влияет на свойства веществ и каково её биологическое значение, а также установим факторы, разрушающе действующие на водородную связь.
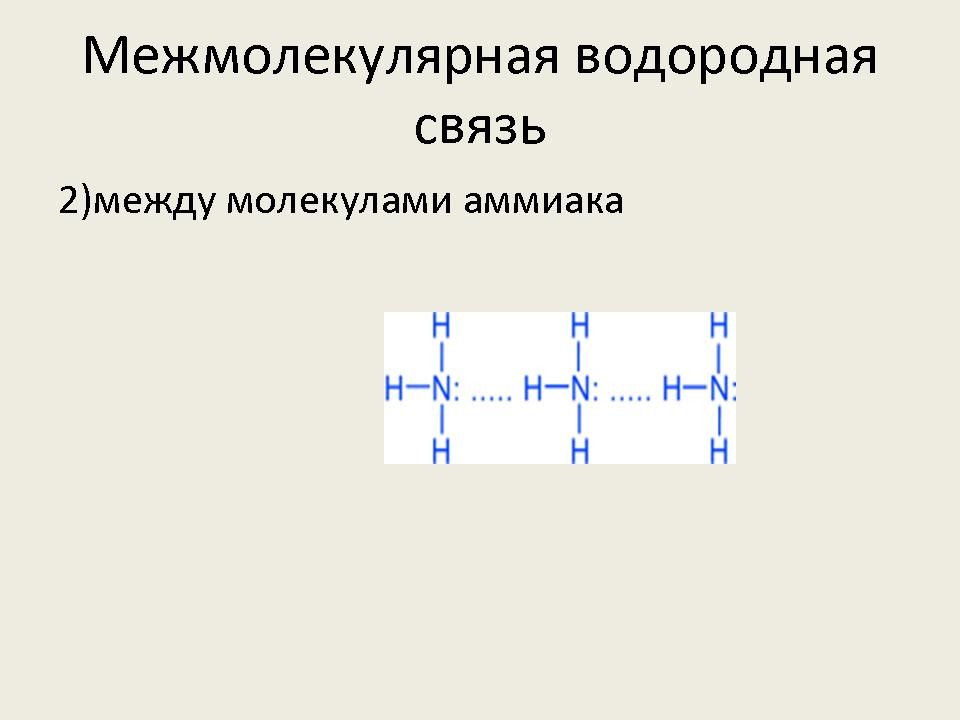
Впервые с водородной связью вы познакомились, когда изучали аммиак. При изучении этилового спирта, уксусной и муравьиной кислот тоже говорили о водородной связи. Дадим определение водородной связи (слайд №2).
Задание.
Запишите в тетрадь определение водородной связи.
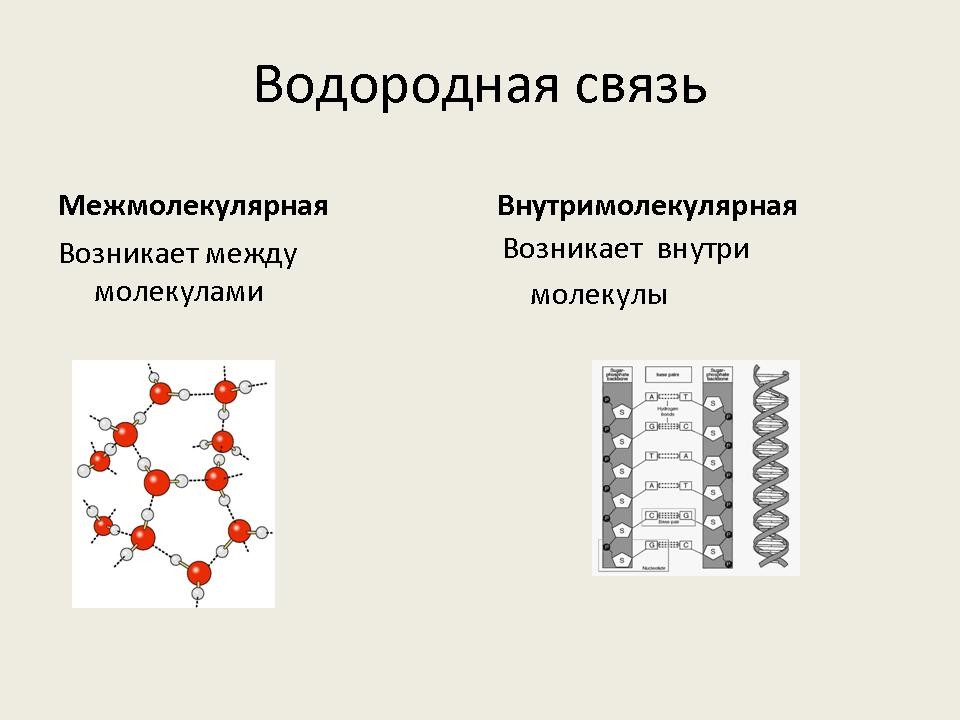
– Какие виды водородной связи существуют? Почему они так называются? (Слайд №3)
Задание.
Запишите в тетрадь виды водородной связи в виде схемы. Лист разделите на две половины.
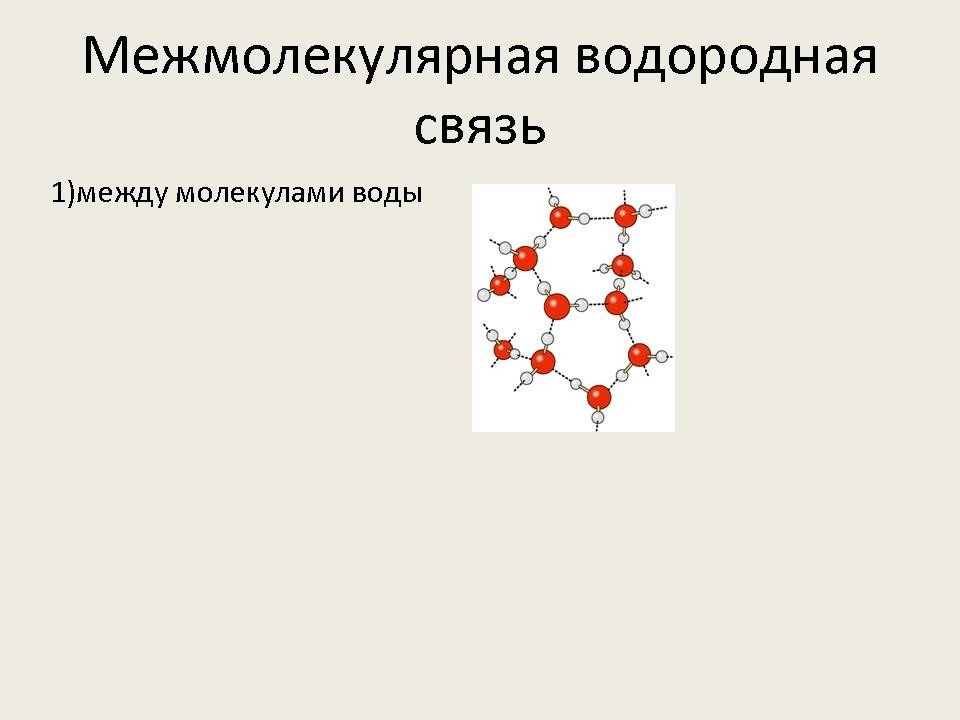
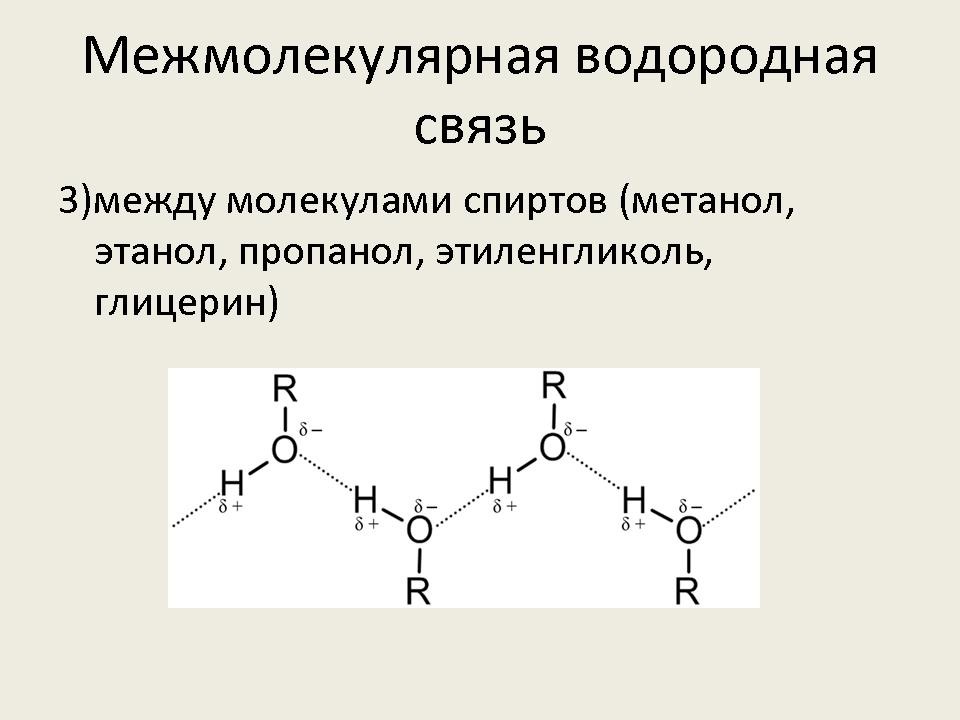
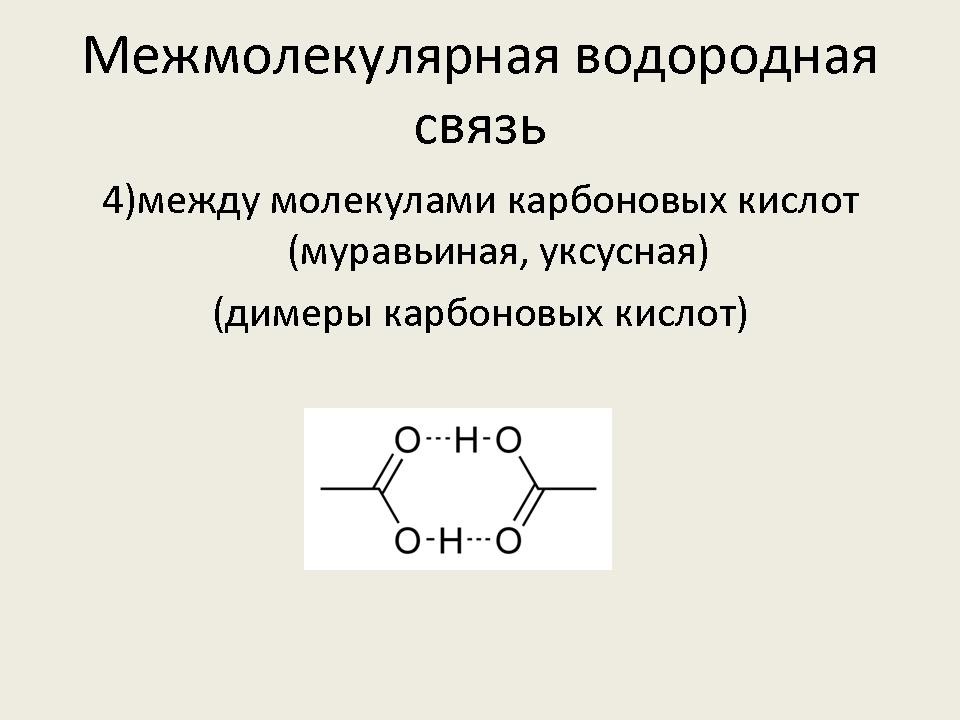
– Рассмотрим более подробно межмолекулярную водородную связь. Она характерна для следующих веществ: воды, спиртов, карбоновых кислот, аммиака, фтороводорода.
(Слайды № №4-8)
Задание.
Запишите в левой колонке вещества, между молекулами которых образуется водородная связь.
– При изучении других типов химической связи мы говорили, какими характерными свойствами обладают вещества, образованные той или иной химической связью. Для веществ с межмолекулярной связью также присущи особые свойства.
- Наличием водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода, спирты – метанол, этанол, пропанол, карбоновые кислоты – мураьиная, уксусная) или легко сжижаемые газы (фтороводород, аммиак). (Слайд №9)
- Некоторые спирты – метанол, этанол, глицерин, этиленгликоль, уксусная и муравьиная кислоты неограничеснно растворяются в воде. (Слайд №10) (Демонстрация растворения в воде глицерина, уксусной кислоты и этилового спирта).
- Образованием водородных связей объясняется аномально высокие температуры кипения (1000) и температуры плавления (00) воды и других веществ. (Слайд №11)
- Водородные связи в немалой степени способствуют образованию кристаллов в виде снежинок и измороси. (Слайд №12)
Задание.
Запишите в тетрадь особенные свойства веществ, образованных водородной связью.
– Теперь рассмотрим вещества с внутримолекулярной водородной связью. Заполняем правую колонку опорного конспекта.
К веществам с внутримолекулярной водородной связью относятся природные биополимеры – пептиды и нуклеиновые кислоты.
- В молекулах белков водородная связь определяет вторичную структуру. (Слайд № 13) Полипептидная цепь закручена в спираль, витки которой удерживаются от раскручивания за счет образования водородных связей между пептидными фрагментами участков белковой молекулы.
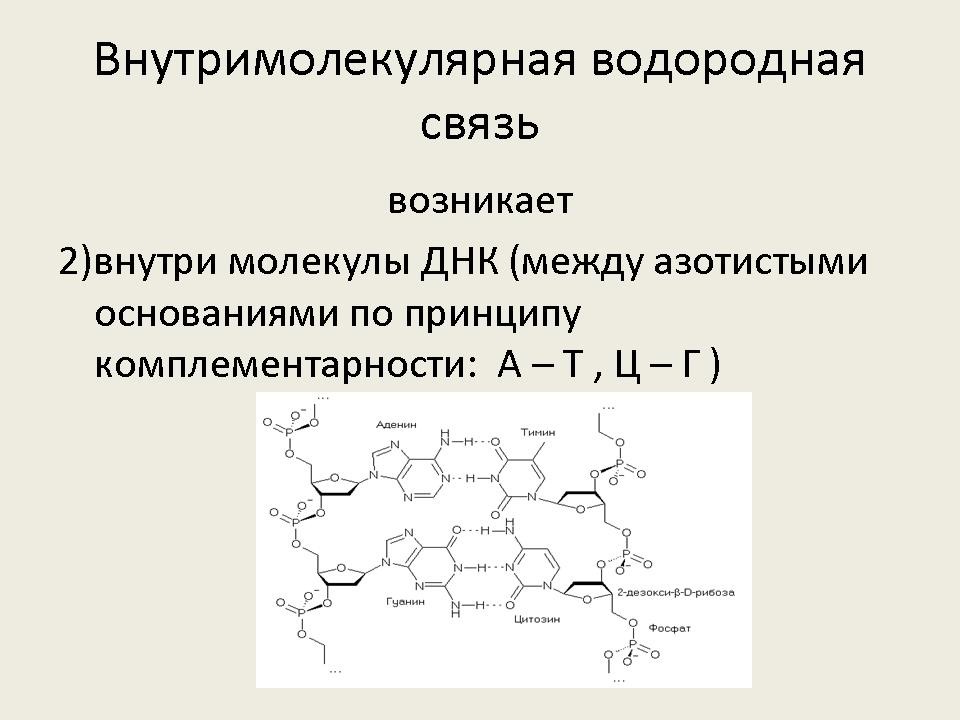
- Двойная спираль ДНК построена по принципу комплементарности. (Слайд №14)
Напротив аденинового нуклеотида (А) одной полунуклеотидной цепи всегда располагается только тиминовый нуклеотид (Т) другой полинуклеотидной цепи, а напротив гуанинового (Г) нуклеотида – цитозиновый (Ц) нуклеотид. Между этими нуклеотидами возникают водородные связи: между А и Т – две водородные связи, между Ц и Г – три.
Задание.
Запишите названия веществ с внутримолекулярной водородной связью.
– Каково значение внутримолекулярной водородной связи? (Слайд №15)
- Внутримолекулярная водородная связь имеет большое значение в организации структур белковых молекул.
- Внутримолекулярная водородная связь определяет функционирование нуклеиновых кислот: хранение и передача наследственной информации (репликация, транскрипция, трансляция).
Задание.
Запишите во второй колонке значение внутримолекулярной водородной связи.
– Каков механизм образования водородной связи?
Механизм образования водородной связи имеет двойную природу. (Слайд №16)
С одной стороны, он состоит в электростатическом притяжении атома водорода, имеющего частично положительный заряд, и атома кислорода (фтора или азота), имеющего частично отрицательный заряд. С другой стороны, в образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота).
Задание.
Запишите соответствующую схему в тетрадь.
– Водородная связь непрочная. Она легко может разрушаться в белковых молекулах. Белки денатурируют. Денатурация бывает обратимой и необратимой. Обратимая денатурация белков имеет социальное значение. Денатурирующими факторами белков человеческого организма могут служить вибрации, высокие температуры, электромагнитное излучение, химические вещества. (Слайд №17)
Демонстрация опыта: денатурация куриного белка под действием азотной кислоты и под действием сульфата меди.
Задание.
Запишите факторы, которые оказывают на белок человеческого организма денатурирующее воздействие.
IV.Закрепление.
Беседа по вопросам.
– Используя составленный опорный конспект, ответьте на вопросы.
- Какая химическая связь называется водородной?
- Какие виды водородной связи существуют?
- Для каких веществ характерна межмолекулярная водородная связь?
- Какие особые свойства присущи веществам с межмолекулрной водородной связью?
- Для каких веществ характерна внутримолекулярная водородная связь?
- Каково значение внутримолекулярной связи?
- Каков механизм образования водородной связи?
V.Домашнее задание.
Выучить опорный конспект, ответить на вопросы №№1, 2, 3, 4, 5, 6 параграфа 6.