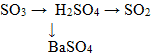Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 1
1. В VIА группу не входит элемент:
а) О
б) S
в) Se
г) Cr
2. Число электронных слоёв и число валентных электронов в атоме серы соответственно равны:
а) 4 и 6
б) 3 и 6
в) 2 и 6
г) 4 и 5
3. Сера проявляет степень окисления +6 в соединении:
а) SО2
б) H2SO3
в) SО3
г) H22S
4. С сероводородом взаимодействуют все вещества, указанные в ряду:
а) Н2О, Cu, Cu(OH)2
б) CО2, HCl, KOH
в) SО3, S, Zn(OH)2
г) О2, CuCl2, NaOH
5. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
а) магний;
б) медь;
в) цинк;
г) железо.
6. C образованием газа идёт реакция, схема которой
а) Li2SO4 + Ba(OH)2 →
б) H2SO4 + Ca(OH)2 →
в) K2SO3 + H2SO4 →
г) H2S + NaOH→
7. «Вещество обугливает органические вещества, отнимая от них воду. Попадание его на кожу приводит к тяжелым ожогам» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) сероводороду;
г) к сернистому газу.
8. Коэффициент перед формулой окислителя в уравнении реакции между концентрированной серной кислотой и медью равен:
а) 1
б) 2
в) 3
г) 4
9. Осуществите превращения: H2S → SО2 → Na2SO3 → Na2SO4
К 3 уравнению составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 2
1. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
а) 4 и + 16;
б) 6 и + 32;
в) 6 и + 16;
г) 4 и + 32.
2. Сколько электронов недостает атому селена для завершения своего внешнего энергетического уровня?
а) 2;
б) 6;
в) 8;
г) 4.
3. Сера проявляет степень окисления +4 в соединении:
а) H2S;
б) K2SO4;
в) Na2SO3;
г) SO3.
4. С оксидом серы (VI) взаимодействуют все вещества, указанные в ряду:
а) Н2О, О2, NaCl
б) CaО, NaCl, Cu(OH)2
в) CО2, K2О, Ca(OH)2
г) H2О, BaO, NaOH
5. B разбавленной серной кислоте растворяется:
а) Cu;
б) Zn;
в) Ag;
г) Au.
6. C образованием осадка идёт реакция, схема которой
а) Na2SO4 + KCl →
б) H2SO4 + BaCl2 →
в) CuCl2 + H2SO4 →
г) CuSO4 + HCl →
7. «Это вещество не растворимо в воде, но хорошо растворяется во многих органических растворителях» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) сероводороду;
г) сере.
8. Коэффициент перед формулой восстановителя в уравнении реакции между сероводородом и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: S → H2S → SО2 → Na2SO3
К 3 уравнению составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 3
1. В атомах элементов VIА группы одинаковое число:
а) электронных энергетических уровней;
б) электронов;
в) электронов на внешнем энергетическом уровне;
г) протонов и нейтронов.
2. Число электронных слоёв и число валентных электронов в атоме селена соответственно равны:
а) 4 и 6
б) 3 и 6
в) 2 и 6
г) 4 и 5
3. Минимальную степень окисления сера проявляет в соединении:
а) S;
б) Na2SO4;
в) SO2;
г) Н2S.
4. В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При действии разбавленной серной кислоты на серебро:
а) образуются сульфат серебра(I) и водород;
б) образуются сульфат серебра(I) и вода;
в) образуются сульфид серебра(I) и вода;
г) реакция не идет.
6. С оксидом серы (IV) взаимодействуют все вещества, указанные в ряду:
а) Н2О, О2, Ca(OH)2
б) KОH, Na2O, Ba(NO3)2
в) CО2, CaО, CaCO3
г) H2S, FeCl3, Cu(OH)2
7. «Желтое кристаллическое вещество, которое используют при производстве спичек» – данное высказывание относится к:
а) сульфату бария;
б) сульфиду свинца;
в) сероводороду;
г) сере.
8. Коэффициент перед формулой восстановителя в уравнении реакции между оксидом серы (IV) и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: H2S← СuS → SО2 → SО3
К 3 уравнению составьте электронный баланс, назовите окислитель и восстановитель.
Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 4
1. В атомах элементов подгруппы кислорода одинаковое число:
а) электронных энергетических уровней;
б) электронов на втором энергетическом уровне;
в) валентных электронов;
г) протонов и нейтронов.
2. Самой большой электроотрицательностью обладает:
а) O;
б) S;
в) Se;
г) Te.
3. Окислительные свойства оксид серы(IV) проявляет в реакции:
а) SO2 + NaOH = NaHSO3;
б) SO2 + Br2 + 2H2O = H2SO4 + 2HBr;
в) SO2 + 2H2S = 3S + 2H2O;
г) 2SO2 + O2 = 2SO3.
4. В сокращенном ионном уравнении реакции сульфата натрия с нитратом бария сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При нагревании медь реагирует c:
а) соляной кислотой;
б) сероводородной кислотой;
в) концентрированной серной кислотой;
г) разбавленной серной кислотой.
6. Коэффициент перед формулой восстановителя в уравнении реакции между цинком и раствором сульфата меди (II) равен:
а) 4
б) 3
в) 2
г) 1
7. «Нелетучее, крайне гигроскопичное вещество, при растворении которого в воде выделяется большое количество теплоты» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) олеуму;
г) к сероводородной кислоте.
8. Укажите схему возможной реакции:
а) Na2SO4 + KCl →
б) H2SO4 + Li2SO4 →
в) H2SO4(разб.) + Hg →
г) CuSO4 + NaOH →
9. Осуществите превращения: S → ZnS→ H2S →SО2
К 3 уравнению составьте электронный баланс, назовите окислитель и восстановитель.
Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 5
1. Число энергетических уровней и число валентных электронов в атоме серы равны соответственно
а) 6 и 4;
б) 4 и 6;
в) 3 и 2;
г) 5 и 6.
2. Сера проявляет степень окисления -2 в соединении:
а) H2S;
б) K2SO4;
в) Na2SO3;
г) SO3.
3. Реакции полного сгорания сероводорода соответствует схема превращения:
![]()
4. В сокращенном ионном уравнении реакции серной кислоты с карбонатом калия сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При взаимодействии оксида серы (IV) с раствором гидроксида калия могут образоваться соли:
а) K2SO4 и KНSO4;
б) K2SO3 и K2SO4;
в) K2SO3 и KНSO3;
г) KНSO3 и KНSO44.
6. Оксид серы(IV) является:
а) основным
б) кислотным
в) амфотерным
г) несолеобразующим
7. «Легкоплавкое вещество, которое очищают от примесей путем плавления» – данное высказывание относится к:
а) сульфиду магния;
б) сульфату бария;
в) сероводороду;
г) сере.
8. Укажите схему возможной реакции:
а) Cu + FeSO4 →
б) H2SO4(разб.) + Fe(OH)2 →
в) H2SO4(разб.) + Cu →
г) K2SO4 + NaOH →
9. Осуществите превращения:
К реакции ионного обмена составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода»
ВАРИАНТ 6
1. Группу элементов – кислород, сера, селен, теллур и полоний – нельзя назвать:
а) халькогенами;
б) элементами подгруппы кислорода;
в) галогенами;
г) элементами VIа группы.
2. Сера проявляет степень окисления -2 в соединении:
а) SO2;
б) Н2SO3;
в) К2SO32;
г) СS2
3. Взаимодействию концентрированной серной кислоты с медью соответствует схема превращения:
![]()
4. В сокращенном ионном уравнении реакции серной кислоты с гидроксидом алюминия сумма коэффициентов равна:
а) 3;
б) 4;
в) 5;
г) 8.
5. Оксид серы (VI) взаимодействует с каждым из двух веществ:
а) вода и хлороводород;
б) оксид кальция и гидроксид натрия;
в) кислород и оксид магния;
г) вода и медь.
6. Практически осуществима реакция между раствором сульфита натрия и растворами:
а) нитрата лития;
б) нитрата аммония;
в) хлорида натрия;
г) азотной кислоты.
7. «Вещество с резким характерным запахом воспламеняющейся спички» – данное высказывание относится к:
а) сернистому газу;
б) хлороводороду;
в) сероводороду;
г) оксиду серы(VI).
8. Коэффициент перед формулой восстановителя в уравнении реакции между сероводородом и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: S → SО2 → Na2SO3 → SО2
К 1 уравнению составьте электронный баланс, назовите окислитель и восстановитель.