Цели урока:
Образовательные:
- актуализировать и углубить знания о классе неорганических веществ “Кислоты”;
- изучить химические свойства класса неорганических веществ “Кислоты”.
Развивающие:
- развить познавательный интерес, реализуя межпредметные связи курсов химии, ИКТ и используя цифровые образовательные интернет ресурсы коллекций ЕК ЦОР и ФЦИОР;
- формировать навыки использования компьютерных технологий.
Воспитательные:
- воспитание бережного отношение к собственному здоровью и здоровью окружающих, умение работать в малых группах.
Оборудование:
- Мобильный класс;
- Мультимедиа проектор;
- Сеть Интернет;
- Интернет-ресурсы из единой коллекции цифровых образовательных ресурсов (ЦОР) и федерального центра информационно-образовательных ресурсов (ФЦИОР);
- Реактивы и инструкции для проведения эксперимента;
- Тест “Химические свойства кислот”;
- Сайт – спутник урока.
Используемые технологии преподавания:
- Развивающее обучение;
- Проблемное обучение;
- Кооперация в обучении;
- Компьютерные технологии.
Используемые интернет технологии и ресурсы при создании и проведении урока:
- Сервисы Web 2.0 (Сайты и Документы Google, Blogger);
- Единая коллекция цифровых образовательных ресурсов (ЦОР).
- Федеральный центр информационно-образовательных ресурсов (ФЦИОР).
Этапы подготовки урока:
Этап 1 – Отбор учебных материалов к уроку.
Этап 2 – Подготовка обеспечения урока.
- Подготовка оборудования.
- Установка необходимых программ (ОМС – плеер).
- Подготовка рабочих учебных материалов.
Этап 3 – Проведение урока.
План урока:
- Актуализация опорных знаний и умений.
- Изучение и восприятие нового материала.
- Обзор химических свойств кислот.
- Подробное изучение каждого из химических свойств кислот.
- Закрепление основных ЗУН по теме учащимися на уроке.
- Рефлексия.
Ход урока
Этапы урока согласно плану |
Деятельность преподавателя (П) |
Деятельность обучающихся (О) |
Оргмомент |
П – Приветствует класс, объясняет цели и ход урока, настраивает на продуктивную работу | О – Приветствие |
| 1. Актуализация опорных знаний и умений | П – предлагает обучающимся вспомнить
какие вещества относятся к кислотам и какова
общая формула, отображающая химический состав кислот |
О – дают ответ на вопрос |
| П – предлагает выбрать из перечня
химические формулы относящиеся к классу кислот: H2O, HNO3, Na2SO4, SO3, KOH, H2S, H2SO4, NaCl, HCl, H3PO4 |
О – обсуждают и предлагают варианты ответа | |
| П – выводит на доску слайд с общей
формулой кислот: HnА |
||
П – просит объяснить обучающихся:
|
О – отвечают на вопросы | |
| П – предлагает обучающимся задания для
решения Задание 1.
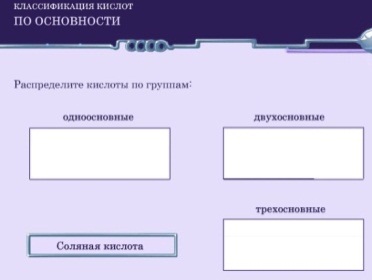
Рис.1. http://files.school-collection.edu.ru/dlrstore/617fdbd0-8cff-11db-b606-0800200c9a66/ch08_38_01.swfЗадание 2.
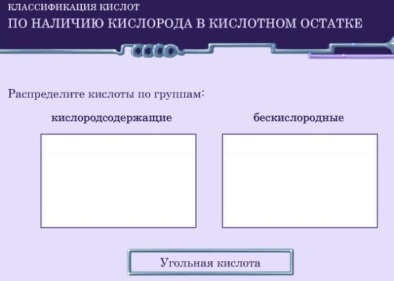
Рис.2. http://files.school-collection.edu.ru/dlrstore/0ab6f5af-4185-11db-b0de-0800200c9a66/ch08_20_10.swfЗадание 3.
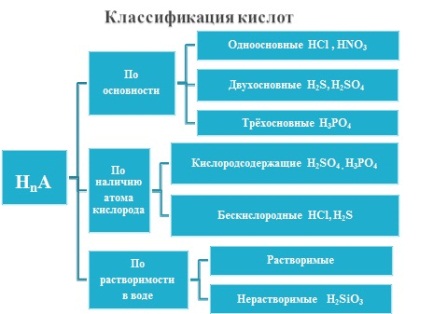
Рис.3. http://files.school-collection.edu.ru/dlrstore/0ab6f5ae-4185-11db-b0de-0800200c9a66/ch08_20_09.swfП – подводит итог , выводит обобщающую схему классификации кислот:
Рис.4. |
О – обсуждают и предлагают варианты ответа | |
| 2. Изучение и восприятие нового
материала I. Обзор химических свойств кислот |
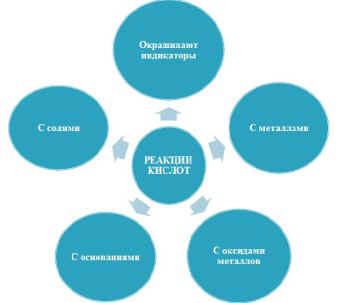
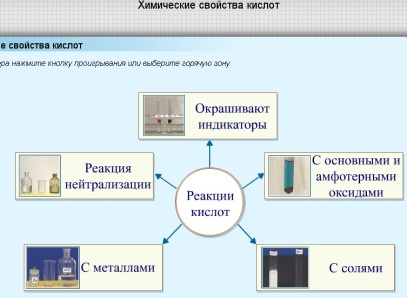
П – проводит обзор химических свойств
кислот, используя схему:
Рис.5. |
О – слушают и записывают схему в тетрадь |
| 2. Изучение и восприятие
нового материала II. Подробное изучение каждого из химических свойств кислот |
П – рассказывает о правилах ТБ при
работе с кислотами
Рис.6. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swfП – говорит об индикаторах и ставит вопрос перед классом |
О – слушают |
| Как должны вести себя индикаторы в растворах кислот? Чем может быть обосновано такое поведение? | О – выдвигают гипотезы | |
| П – предлагает обучающимся провести
эксперимент №1 |
О – используя инструкцию (Приложение 1), проводят эксперимент №1 | |
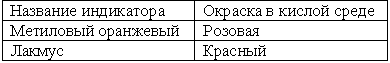
| 1. Кислоты окрашивают индикаторы
П – подробно объясняет химические свойства, используя ЭОР “Химические свойства кислот”
Рис.7. http://fcior.edu.ru/card/9001/himicheskie-svoystva-kislot.html |
О – делают запись таблицы в тетрадях | |
| 2. Кислоты взаимодействуют с
металлами, стоящими в ряду активности до
водорода (Н2): 2НСl + Zn = ZnCl2 + H2^ НСl + Cu ? П – предлагает обучающимся провести эксперимент №2 |
О – используя инструкцию (Приложение 1) , проводят эксперимент №2, делают запись УХР в тетрадях | |
| 3. Кислоты взаимодействуют с
основными и амфотерными оксидами: CuO + H2SO4 = CuSO4 + H2O Al2O3 + 6HCl = 2AlCl3 + 3H2O |
О – слушают, делают запись УХР в тетрадях | |
| 4. Взаимодействие кислот с
основаниями – реакция нейтрализации: HCl + NaOH = NaCl + H2O П – предлагает обучающимся провести эксперимент №3 |
О – используя инструкцию (Приложение 1), проводят эксперимент №3, делают запись УХР в тетрадях | |
| 5. Взаимодействие кислот и солей AgNO3 + HCl = AgClv + HNO3 Na2CO3 + 2HCl = 2NaCl + H2O + CO2^ Неустойчивые кислоты: Н2СО3 - H2O + CO2^ Н2SО3 - H2O + SO2^ П – подводит итог, обращаясь к схеме:
Рис.5. |
О – слушают, делают запись УХР в тетрадях | |
| 3. Закрепление |
П – предлагает обучающимся решить
(работа в парах) Тест |
О – работают в парах над заданиями теста (Приложение 2), делают записи в тетрадях |
| П – обсуждает результаты работы над тестом | О – самопроверка (Приложение 3) и участие в обсуждении | |
| 4. Рефлексия | П – предлагает ответить на вопросы (по
желанию):
|
О – участие в рефлексии |
| П – даёт домашнее задание | О – записывают Д/З |
Литература для обучающихся
- Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений /Г. Е. Рудзитис, Ф. Г. Фельдман. – 11-е издание перераб. – М. : Просвещение, 2007
Интернет-ресурсы
- Сайт – спутник урока https://sites.google.com/site/himiceskiesvojstvakislot/
ЕК ЦОР:
http://files.school-collection.edu.ru/dlrstore/617fdbd0-8cff-11db-b606-0800200c9a66/ch08_38_01.swf http://files.school-collection.edu.ru/dlrstore/0ab6f5af-4185-11db-b0de-0800200c9a66/ch08_20_10.swf http://files.school-collection.edu.ru/dlrstore/0ab6f5ae-4185-11db-b0de-0800200c9a66/ch08_20_09.swf http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swfФЦИОР:
http://fcior.edu.ru/card/9001/himicheskie-svoystva-kislot.htmlПРИЛОЖЕНИЯ:
- Приложение 1. https://sites.google.com/site/himiceskiesvojstvakislot/2-izucenie-i-vospriatie-novogo-materiala/podrobnoe-izucenie-kazdogo-iz-himiceskih-svojstv-kislot/instrukcia-po-provedeniu-eksperimenta
- Приложение 2. https://sites.google.com/site/himiceskiesvojstvakislot/zakreplenie-osnovnyh-zun-po-teme/test-himiceskie-svojstva-kislot
- Приложение 3. https://sites.google.com/site/himiceskiesvojstvakislot/zakreplenie-osnovnyh-zun-po-teme/rezultaty-testa