Цель: через практическую деятельность коммуникативную технологию изучить качественные превращения соединений железа (II) и (III).
- Образовательная: рассмотреть качественные превращения соединений железа.
- Развивающая: отработать аналитическое обнаружение Fe2+ и Fe3+ и применение соединений железа в изобразительном искусстве.
- Воспитательная: развитие коммуникативного взаимодействия в паре.
Тип урока: комбинированный.
Метод проведения: информационный блок через ИКТ силами учащихся, практическая деятельность в паре.
Оборудование:
- Fe; FeCl2; FeSO4; FeCl3; Fe2(SO4)3; KCNS; NaOH; K3[Fe(CN)6]; Na2S; K4[Fe(CN)6]; H2SO4.
- Стаканчики, кисточки или ватные палочки, Лист А4 или А3, перчатки.
Планируемые предметные результаты:
Ученик должен:
- иметь представление о железосодержащих рудах – красный, бурый, магнитный железняки, пирит;
- знать реактивы для обнаружения ионов Fe2+ и Fe3+ и признаки реакций взаимодействий;
- уметь провести практические взаимодействия, соблюдая правила работы с оборудованием и реактивами.
Междисциплинарные связи: история, геология, география, биология.
Сценарий урока
I. Ввод
По какому фактору анализа крови можно предполагать ослабление здоровья человека?
Что вы знаете о составе и функции гемоглобина?
ИКТ – силами учащихся
II. Мотивация учебной деятельности
- Каково значение железа и его соединений для нашей жизни?
ИКТ – презентация в картинках.
III. Открытие новых знаний
Валентные возможности атома железа.
Строение атома железа – учащиеся у доски
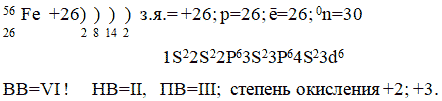
Лабораторный этап
На столах коллекции минералов содержащих железо – железняки – бурый, красный, магнитный, пирит. Рассмотреть образцы, описать их, сравнить. Какой из этих минералов более богат железом.
Устанавливаем формулы:
Бурый – FeO Красный – FeO Магнитный - FeO
Практикум: к порциям растворов FeCL2 и FeCL3 добавим раствор NaOH что наблюдаем? Записываем уравнения и признаки реакций. К порциям Fe (OH)2 и Fe (OH)3 добавим раствор H2O2. Что наблюдаем? Какой вывод можно сделать об устойчивости ионов железа к окислению. Запишем уравнение реакции с помощью электронного баланса.
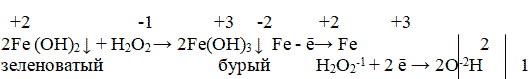
Вопрос: Какой из ионов железа присутствует в свежем яблоке на срезе? Что происходит с поверхностью яблока на воздухе? Почему?
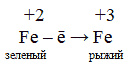
А как на воздухе окисляется железо?
4Fe + 3O2 + 6H2O → 4 Fe(OH)3 ↓
IV. Качественное превращение соединений железа и использование этих превращений для получения колеров
Практикум: K3[Fe(CN)6], K4[Fe(CN)6], Na2S, FeSO4, Fe2(SO4)3, NaOH, KCNS, H2SO4.
Провести взаимодействие солей железа с каждым из реактивов в отдельных стаканчиках составить уравнения реакций, описать качественные изменения.
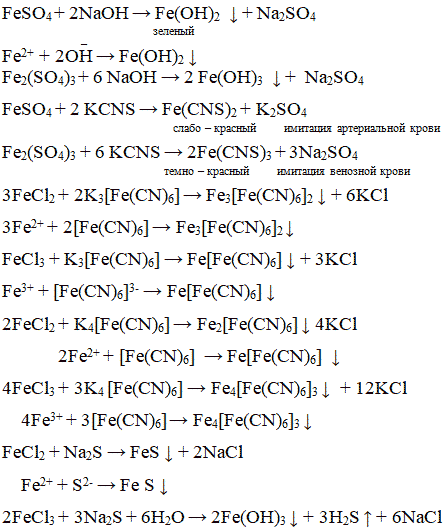
Почему разные результаты с Na2S? В случае Fe3+ идёт вторичный гидролиз так как образуется соль слабых электролитов, которые гидролизуются и по катиону и по аниону.
V. Творческий блок
ИКТ – картины – историческая справка о возникновении красок – учащихся.
Готовим краски в каждый колер добавляем. Рисуем.
Темы рисунков:
- Сказки Пушкина
- Времена года
- Свободная тема
Условие: использовать как можно больше цветов.
Где сейчас применяют колеры на основе соединений железа?
- Акварельные медовые краски.
VI. Рефлексия
- Какими реактивами можно различить ионы Fe2+ и Fe3+.
- Что такое темпера? В каких видах искусства она применяется?
- Показываем рисунки на стенде?
Домашнее задание: Составить и расписать блок-схему по свойствам железа.