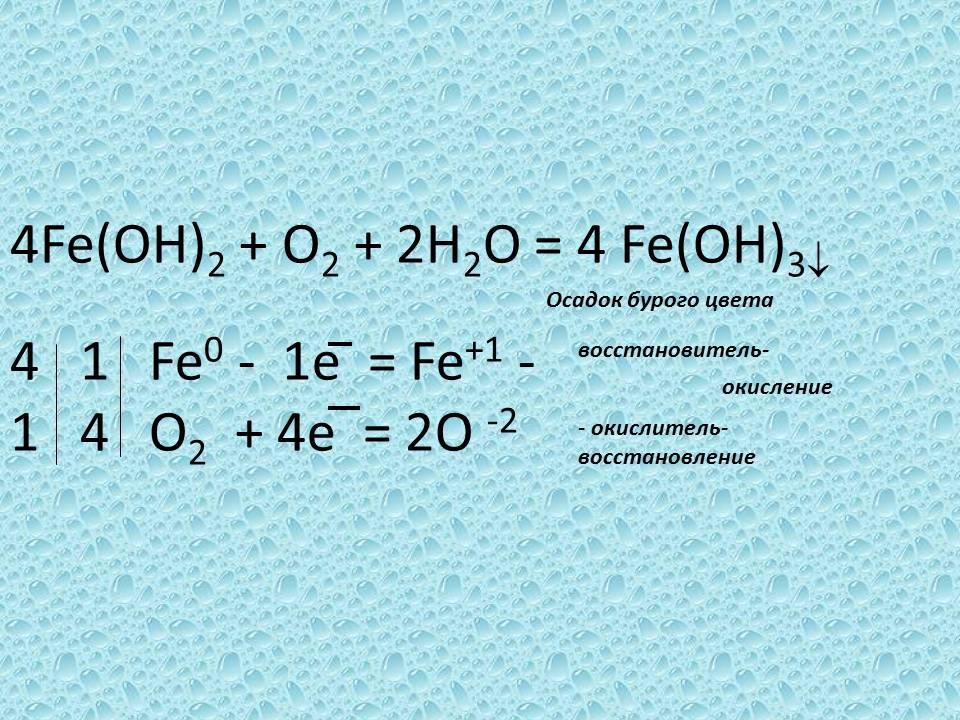Урок-презентация с элементами исследования, мастерской.
Цели урока:
- в процессе исследования изучить физические и химические свойства железа и его соединений;
- развивать дальнейшие умения составлять молекулярные и ионные уравнения химических реакций;
- учить сравнивать, обобщать, анализировать и делать выводы;
- развивать познавательную деятельность через эксперимент и посредством заданий развивающего характера;
- развивать коммуникативные качества личности.
Метод обучения: проблемно-поисковый
Организационные формы: беседа, самостоятельная и практическая работа, сообщения учащихся
Средства обучения: проектор, компьютер, методички с заданиями (Приложение 1)
Реактивы и оборудование: железо (порошок, гвозди), сера, соляная кислота, магнит, пробирки, спиртовка, спички, K(SCN)3 (роданид калия), гексацианоферрат (III) калия (красная кровяная соль).
Программное обеспечение: компьютерная презентация к уроку
Эпиграф к уроку:
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет -
Из элементов состоит единых.
С. Щипачев
Ход урока
I. Введение в тему. Вступительное слово учителя.
Слайд 1.
Ребята! Сегодня мы проведем с вами не традиционный урок. Я предлагаю отправиться в виртуальное путешествие, чтобы познакомиться с “Небесным” металлом. А какой металл называют “Небесным”? Чтобы ответить на этот вопрос обратимся к языку шумеров, по их мнению “Небесный” или “капнувший” с неба – это железо. Почему его так назвали?
Ответ: падает на землю из космоса.
Слайд2
Учитель: верно и впервые в 1775 году русский путешественник П.С. Паллас доказал, что железные камни падают с неба.
Ученик: Внимание! Внимание! Только что на территорию школы опустилась “летающая тарелка”. Из неё выпала вот эта капсула. Братья по разуму передали нам свое послание. Давайте его прочитаем. (Читает)
Слайд 3
Желаем тему изучить,
Друзья наши Земляне!
И получить лишь только “пять”
С приветом,
Марсиане!
Учитель. Своевременное пожелание. Надеюсь, что вы приложите максимум усилий, чтобы изучить тему и получить высокий оценки. А сейчас запишем число ……… и тему урока……
Слайд 4.
Эпиграфом к уроку взяты слова С. Щипачева:
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет -
Из элементов состоит единых.
И так, мы отправились в путешествие во время, которого нам предстоит сделать несколько остановок по требованию.
II. Первая остановка “Историческая” (появление железа на Земле). Сообщение ученика.
Слайд 5
Знакомство человека с железом произошло в давние времена. Есть основания полагать, что образцы железа, которые держали в руках первобытные люди, были неземного происхождения. Входя в состав некоторых метеоритов - вечных странников океана Вселенной, случайно нашедших приют на нашей планете, - метеоритное железо было тем материалом, из которого человек изготовил впервые железные изделия. Железо в самородном состоянии встречается на земле главным образом в виде метеоритного, “космического” железа.
Слайд 6
- 18 октября 1916 года вблизи с. Богуславки Дальневосточного края наблюдали падение метеорита, два его осколка весили по 256 кг.
Слайд 7
- 1920 год - Юго-Западная Африка, метеорит “Гоба” весом около 60 тонн.
Слай8
- 30 июня 1908 г. упал знаменитый Тунгусский метеорит весом 50 тыс. тонн.
Слайд 9.
III. Учитель: Следующая остановка. “Составление паспорта железа как химического элемента” (работа в парах). Работая с Периодической таблицей химических элементов, составьте паспорт железа по алгоритму:
Слайд 10.
- Порядковый номер:
- Период:
- Группа:
- Подгруппа:
- Электронная формула:
(После работы в парах, учитель выслушивает ответы учащихся.)
Учитель. Исходя из строения атома железа, определите его валентные электроны.
Ученик. Железо имеет 8 валентных электронов (два из них на 4s- и шесть на 3d-АО). Однако валентность 8 для железа не характерна; неустойчивы и соединения с шестивалентным железом, например производные железной кислоты H2FeO4, являющиеся сильнейшими окислителями. Обычно железо проявляет валентности равные двум и трем и соответствующие степени окисления.
Учитель. Возникает вопрос: “Какими же свойствами обладает железо как простое вещество?” Что бы получить ответ на него совершим следующую остановку “Физические свойства”
Слайд 11.
Учитель. Работаем в парах по учебнику Новашинских, страница 203, §50 и записываем в тетрадь характерные физические свойства железа.
- Цвет:
- Металлический блеск:
- Твердость:
- Пластичность:
- Теплопроводность:
- Электропроводность:
- Плотность:
- Температура плавления:
(Учитель проверяет выполненную работу в виде беседы с классом.)
Ответ. Железо - серебристо-белый или серый металл, твердый, с высокой пластичностью, теплопроводностью и электропроводностью, плотность его равна 7,87 г/см3, тугоплавкий-1540 0 С. Это самый распространенный химических элементов в природе. В земной коре его массовая доля составляет 5,1%.
Учитель. Какими ещё свойствами обладает железо?
Ответ. Магнитными
Учитель. Совершенно верно, в отличие от других металлов, железо способно намагничиваться, оно обладает ферромагнетизмом. Проведем опыт намагничивание железного гвоздя.
Учитель. Далее разговор наш пойдет об активности железа. Для того, чтобы узнать активность железа по отношению к другим веществам, мы совершим с вами очередную остановку “Экспериментальная”. В этом нам поможет ряд Бекетова или ряд напряжения металлов, и правила по технике безопасности.
Слайд12.
Учитель. Говоря о химических свойствах железа, необходимо отметить, что железо взаимодействует как с простыми, так и сложными веществами. Предлагаю вам провести эксперименты с серой, соляной кислотой, сульфатом меди, объяснить свои наблюдения и составить уравнения химических реакций.
Слайд13
Учитель. Подумайте и ответьте, чем является железо в данных уравнениях реакций?
Слайд.14
Fe + S = FeS
Fe + 2HCI = FeCI2 + H2
Fe + CuSO4 = FeSO4 + Cu
Fe0 - 2e = Fe+2 (восстановитель)
Учитель. Ребята, а что вы наблюдали при проведении третьей реакции?
Ответ. Железо вытеснило медь из раствора сульфата меди.
Учитель. А как вы думаете, взаимодействует ли кислород с железом?
Ответ. Думаем, да.
Учитель. Ваше предположение верно. При высокотемпературном режиме железо горит в кислороде с образованием железной окалины Fe3O4, представляющий собой двойной смешанный оксид (FeO*Fe2O3)
Слайд 15.
Учитель. А как вы думаете, может железо вытеснять водород из воды?
Ответ. Да.
Учитель. Совершенно верно, железо может вытеснять водород из воды, но только при сильном нагревании
Слайд16
Fe + H 2O = FeO +H2
Fe0 - 2e = Fe+2 - восстановитель - окисление
2H+ + 2е = Н02 - окислитель - восстановление
Учитель. Итак, с какими оксидами мы познакомились?
Ответ. Оксидом железа (II) и оксидом железа (III).
Учитель. Подумайте действует ли вода и кислород на железо?
Ответ. Возможно.
Учитель. Однозначного ответа здесь нет, чтобы ответить на этот вопрос необходимо знать условия протекания реакции. Так при обычных условиях вода не действует на железо, однако, в присутствии кислорода протекает следующая реакция:
Слайд 17
4Fe +6H2O +3O2 + 4 Fe(OH)3v
4 |3| Fe0-3e =Fe+3 – восстановитель, окисление.
3 |4| O-2 + 4e = 2O-2окислитель, восстановление.
Эта реакция прошла в пробирке под №1. В ней образовался Fe(OH)3 - гидроксид железа (III) - основная часть ржавчины. Для протекания данной реакции необходимо одновременно присутствие воды и кислорода, в противном случае коррозия так и не наступит. Известно, что в течение многих столетий стоит знаменитая железная колонна Кутубская в столице Индии Дели. Почему?
Ответ. Там сухой воздух.
Учитель. Не только. Эта колона была изготовлена из очень чистого металла: железа в колоне оказалось 99,72%отсутствие примесей и обеспечило ей долговечность.
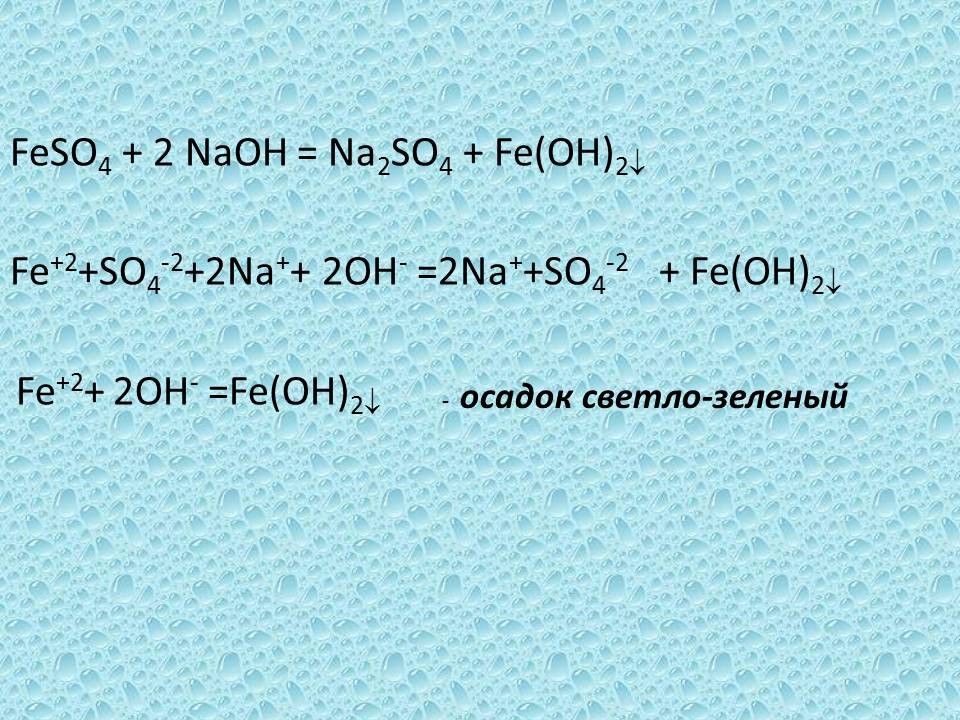
Учитель. Продолжим, предлагаю, ребята, провести опыт: реакцию обмена между сульфатом железа (II) и гидроксидом меди, записать уравнение химической реакции в молекулярном и ионном виде
слайд № 18
FeSO4 + 2 NaOH = Na2SO4 + Fe(OH)2
Fe+2+SO4-2+2Na++ 2OH- =2Na++SO4-2 + Fe(OH)2
Fe+2+ 2OH- =Fe(OH)2 - осадок светло-зеленый
(После записи уравнений учитель предлагает учащимся вернуться к полученному осадку.)
Обратите внимание на только что полученный осадок. Как изменился цвет осадка? Что произошло?
Ответ. Изменился цвет осадка, из зеленного он стал коричневым.
Учитель. Изменение цвета указывает на то, что соединение железа двухвалентного неустойчиво и окисляется, превращаясь в соединение железа трехвалентного бурого цвета.
Слайд № 19
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3 - осадок бурого цвета
4 ¦ 1 ¦ Fe0 - 1e = Fe+1 – восстановитель, окисление
1 ¦ 4¦ O2 + 4е = 2О -2 – окислитель, восстановление
Учитель. Познакомимся с качественными реакциями на ионы железа (II) и железа (III).
Слайд 20
FeCI3 + 3KSCN = 3KCI + Fe(SCN)3 - роданид железа(III).
2[Fe(CN)6]3- +3Fe2+ = Fe3[Fe(CN)6] - турнбулева синь.
Учитель.
Что вы узнали во время данной остановки? Какими свойствами обладает железо как простое вещество? Сделайте вывод.
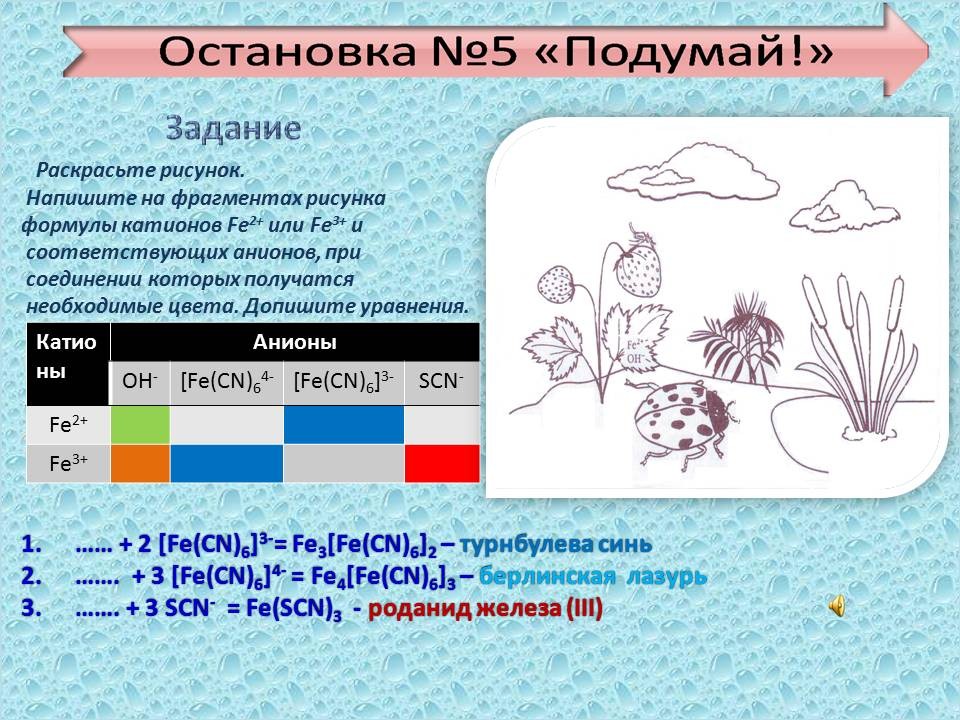
Учитель следующая остановка № 5. “ Подумай!” (слайд № 21). Приложение 1
Раскрасьте рисунок. Приложение 2
Напишите на фрагментах рисунка формулы катионов Fe2+ или Fe3+ и соответствующих анионов, при соединении которых получатся необходимые цвета. Допишите уравнения реакций.
(Работа по методичкам, в результате которой учащиеся должны написать возможно протекающие реакции).
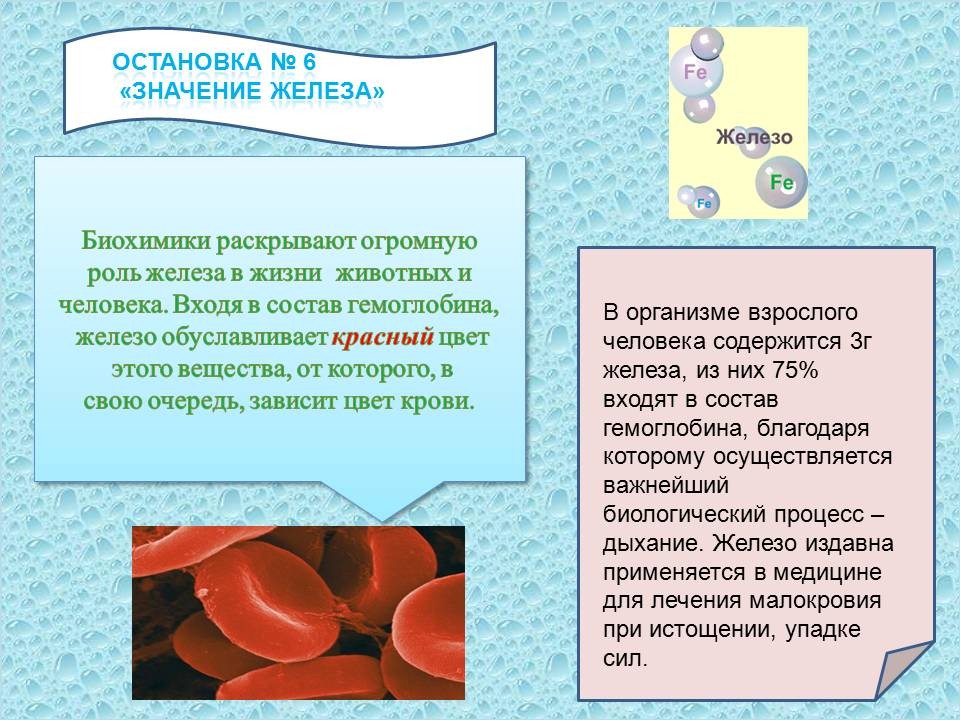
VII. Остановка № 6. “Значение железа” (сообщение ученика)
Слайд 22.
Биохимики раскрывают огромную роль железа в жизни растений, животных и человека. Входя в состав гемоглобина, железо обуславливает красный цвет этого вещества, от которого, в свою очередь, зависит цвет крови. В организме взрослого человека содержится 3 г железа, из них 75% входят в состав гемоглобина, благодаря которому осуществляется важнейший биологический процесс - дыхание. Железо необходимо и для растений. Оно участвует в окислительных процессах протоплазмы, при дыхании растений и в построении хлорофилла, хотя само и не входит в его состав.
Железо издавна применяется в медицине для лечения малокровия, при истощении, упадке сил.
Слайд 23.
Железо - основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений - от башни Эйфеля до ажура железнодорожных мостов. Все, все - начиная от швейной иглы, гвоздя, топора и кончая паутиной железных дорог, плавающими крепостями - авианосцами и линкорами - и огнедышащими домнами, где рождается само железо, - состоит из железа. Железо - это металл созидания!
Слайд 24. ГИМН ЖЕЛЕЗУ.
VIII. Подведение итогов урока. Рефлексия.
Слайд 25.
Учитель. В завершении путешествия поделитесь своими впечатлениями. Для этого допишите предложения, посвященные сегодняшнему уроку:
- Сегодня я узнал (а)______________________________________
- Я удивился (лась)_______________________________________
- Теперь я умею _________________________________________
- Я хотел (а) бы __________________________________________
Домашнее задание: на основе материала учебника параграф 50 и выполнить творческое задание по данной теме, например:
Творческое задание 1.

Источники.
- Ю.Е.Фатеева “Железо: его строение и свойства”. Фестиваль педагогических идей “Открытый урок” 2004-2005 учебный год
- Я иду на урок: 8-11 классы, 2002г., А.А. Мягков.
- Химия, 2002, №25-26, химия в стихах, В.П.Куликова.
- Я иду на урок: 5-11 классы, 2003г., А.И. Лебедев.
- ХВШ № 32/2004г. Творческий подход к проведению практических работ, С.А. Марухленко.
- А.Н. Дубовицкая “Пришелец из космоса”. Фестиваль педагогических идей “Открытый урок” 2004-2005 учебный год
- http://stat18.privet.ru/lr/0a15dba490a81e947bd164a9b257230a
- http://www.medikforum.ru/news/uploads/posts/2013-08/1376534174_asteroid.jpg
- http://mif-facts.com.ua/wp-content/uploads/2014/03/%D0%A2%D1%83%
D0%BD%D0%B3%D1%83%D1%81%D1%81%D0% - BA%D0%B8%D0%B9-%D0%BC%D0%B5%D1%82%D0%B5%
D0%BE%D1%80%D0%B8%D1%82-3.jpg - http://www.bankgorodov.ru/photo/1348128685
- http://my-ivanovo.ru/wp-content/uploads/2011/07/14-1249459277_asteroid.jpg
- http://img-fotki.yandex.ru/get/6303/137563163.88/0_67c63_3c8e2c91_XL
- http://www.savok.org/uploads/posts/2010-06/1275473349_rrsrrsryos-3.jpeg
- http://yandex.ru/images/search?source=related-2&img_url=http%3A%2F%
2Fpodrobnosti.ua%2Fupload%2Fnews%2F2013%2F08%2F21 - http:// http://data9.gallery.ru/albums/gallery/156685-a4108-21063982-.
jpgwww.savok.org/uploads/posts/2010-06/1275473349_rrsrrsryos-3.jpeg - http://www.meteovesti.ru/pictures/63506810300.jpg
- http://bizon.org.ua/img/stati/metall1.gif
- http://yandex.ru/images/search?img_url=http%3A%2F%2Fp1.pkcdn.com%
2Firon-bridge-treto_688219.jpg&uinfo=sw-1920-sh-1080-ww-1899-wh-
968-pd-1-wp-16x9_1920x1080&_=1418454990424&p=6&viewport=
wide&text=%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD
%D0%BA%D0%B8%20%D0%B6%D0%B5%D0%BB%D0%B5%D0
%B7%D0%BD%D1%8B%D0%B5%20%D0%BC%D0%BE%D1%81%
D1%82%D1%8B&pos=198&rpt=simage&pin=1 - http://static.freepik.com/fotos-kostenlos/angel_2786908.jpg