Тип урока: урок изучения нового материала
Цель: создать условия для усвоение учащимися материала курса химии по теме: “Оксиды углерода” на уровне компетенции посредством активного изучения теоретического материала.
Применяемые приемы, методы и технологии: проблемный подход в обучении, игровые технологии, беседа, индивидуальная и групповая работа, эксперимент.
Задачи:
- Воспитательные - воспитание бережного отношения к своему здоровью, окружающей природе, формирование научного мировоззрения (о реальности существования этих оксидов и связанных с ними превращений), дать каждому ученику возможность достичь успеха
- Образовательные – систематизировать знания учащихся о кислотных оксидах на примере оксидов углерода, усвоить строение, физические свойства, химические свойства, получение и применение угарного и углекислого газов, качественную реакцию на углекислый газ, физиологическое действие на организм человека угарного и углекислого газа, продолжить работу по развитию умений сравнивать, составлять уравнения реакций, работать с текстом учебника, получать информацию из сети Интернет
- Развивающие - развивать умение работать в атмосфере поиска, познавательного интереса к химии, используя данные о значении изучаемых веществ и явлений в окружающей жизни, развитие коммуникативных умений и навыков, формирование умений парной и групповой работы в раскрытии причинно-следственных связей, развитие умений самостоятельно ставить и формулировать для себя новые задачи, определять способы действий и соотносить с планируемыми результатами.
Методы: словесные, наглядные, исследовательские
Оборудование для учителя: компьютер, мультимедиа проектор.
Оборудование для учащихся: лабораторная посуда (пробирки, штатив для пробирок, химические стаканы), раздаточный материал (опорные конспекты, памятки для учащихся).
Ход урока
1. Организационный момент.
Здравствуйте. Приятно видеть знакомые лица. Мы с вами сегодня партнеры.
Девизом нашего сегодняшнего урока могут послужить слова Конфуция:
Перед человеком к разуму три пути:
- Путь размышления - это самый благородный;
- Путь подражания - это самый легкий;
- Путь личного опыта - это самый тяжелый.
Я предлагаю выбрать сегодня 3 путь, но каждый из вас может и не прислушаться к моим словам и выбрать любой другой.
2. Подготовка к основному этапу урока
Учитель формулирует задачи урока
В произведении Одоевского В.Д. “Мороз Иванович” есть следующий отрывок:
"- А зачем ты, Мороз Иванович, - спросила Рукодельница, - зимою по улицам ходишь, да в окошки стучишься?
- А я затем в окошки стучусь, - отвечал Мороз Иванович, - чтоб не забывали печей топить, да трубы вовремя закрывать; а не то ведь, я знаю, есть такие неряхи, что печку истопят, а трубу закрыть не закроют, или закрыть закроют, да не вовремя, когда ещё не все угольки прогорели, а от того в горнице угарно бывает, голова у людей болит, в глазах зелено; даже и совсем умереть от угара можно".
О чём пойдёт речь сегодня на уроке?
Учитель: В другом произведении В. Короткевича “Чёрный замок Ольшанский. Дикая охота короля Стаха” мы читаем:
"Вы слышали об эффекте "собачьей пещеры" в Италии. Есть там такая пещера-яма. Человек войдёт и ходит, а собака или кролик погибают через несколько минут.
- Почему?
- Из вулканической трещины выделяется углекислый газ...".
А поскольку он...”
Закончите фразу. Объясните “ загадочную гибель животных”
ОТВЕТ: (А поскольку углекислый газ тяжелее воздуха, то он остаётся внизу. Человеческая голова выше этой зоны. Собачья – нет...”
Можете ли вы сейчас ответить на этот вопрос?
Тема сегодняшнего урока “Оксиды углерода (II) и (IV) – друзья или враги?”. Предложите план изучения данной темы (план заносится в таблицу)
| Признаки сравнения | СО (угарный газ) | СО2 (углекислый газ) |
| Строение молекулы | ||
| Физические свойства | ||
| Химические свойства | ||
| Физиологическое действие на организм | ||
| Способы получения | ||
| Применение |
Учитель: Владеете ли вы всей необходимой информацией, чтобы сейчас заполнить данную таблицу???
2. Усвоение новых знаний и способов действий
Учитель: а в природе эти оксиды существуют? Вместе с учащимися называет пути поступления оксидов углерода в атмосферу. Углекислый газ часто называют “парниковый газ”. Как вы думаете, почему? и с чем это связано?
Высказывают мнения, объясняют суть парникового эффекта
(Земля получает энергию от Солнца и сама излучает в космическое пространство часть тепла. Но многие содержащиеся в ее атмосфере газы, в том числе и СО2, удерживают часть тепла.
За последние десятилетия концентрация СО2 в атмосфере медленно, но неуклонно повышается, а с ней из-за парникового эффекта – и температура (за последние 100 лет – на полградуса). По прогнозам, к 2025 году содержание углекислого газа в воздухе может удвоиться. Казалось бы, мелочь, для дыхания человека это несущественно, а для растений это благоприятно. Но ведь среднегодовая температура вырастет на несколько градусов. Это очень много: начнут таять льды Арктики и Антарктики, уровень Мирового океана повысится, и под водой окажутся огромные территории. Если это произойдет, то будет уничтожена большая часть полей. Некоторые страны потеряют все культурные земли, в других странах лучшие сельскохозяйственные регионы изменят своё местонахождение. Кроме того, изменится климат Земли, и мы даже не знаем точно, к каким катастрофическим последствиям это приведет.
Ученые предсказывают, что двукратное повышение уровня СО2 в атмосфере по сравнению с доиндустриальной эпохой поднимет общую среднюю температуру на 2,80С. Наибольшее увеличение температуры произойдет в северном полушарии на широте около 400, где больше всего сжигается топлива и значительнее сезонные влияния на жизнь растений.
По оценке американских специалистов, потепление климата в ближайшие 100 лет приведет США к затоплению 80% прибрежных территорий.)
Мы узнали, откуда берутся эти оксиды в природе и почему СО2 называют “парниковый газ”. Хватит ли нам этих знаний? А что же еще нам нужно знать об этих веществах? И как мы будем это делать?
(Далее можно дать задания по группам)
Учитель. Мудрая китайская пословица гласит
“Я слышу – я забываю, Я вижу – я запоминаю, Я делаю – я понимаю”.
3. Первичная проверка понимания
Учитель предлагает использовать дополнительные материалы, которые лежат на столах для получения информации, необходимой для заполнения таблицы. Учащиеся изучают эту информацию.
1 группа Строение молекул СО и СО2
I. Угарный газ — оксид углерода (II)
Рассмотрение строения СО начните с определения степени окисления элементов С+2 О-2 и соответственно с вывода, сколько электронов передал в общее пользование атом углерода (два), а значит, и сколько электронов оттянул к себе более электроотрицательный кислород — два.
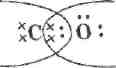
Однако дальнейшее рассмотрение строения СО показывает, что при таком раскладе у углерода не будет заветной восьмерки электронов на внешнем уровне — четыре своих и два общих с атомом кислорода. Как быть? Очевидно, атому кислорода придется передать в общее пользование одну свою свободную электронную пару, т. е. выступить в качестве донора. Акцептором, разумеется, будет атом углерода:
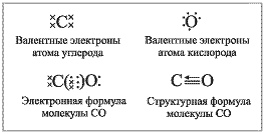
т.е. ковалентных связей будет три, а оттянутых от углерода к кислороду электронов — два (с. о. +2).Связь в молекуле СО – ковалентная полярная. Число смещенных от углерода к кислороду электронов – два, значит степень окисления атома углерода +2. У атома углерода в молекуле СО имеется два свободных электрона, значит СО может участвовать в реакциях, проявляя восстановительные свойства. Такое возможно с такими окислителями как кислород, галогены и даже оксиды металлов
II Углекислый газ
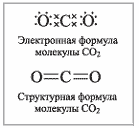
Все четыре связи – ковалентные полярные и образовались за счет обобществления электронов атомами углерода и кислорода. Однако из-за линейного строения молекула CO2 в целом неполярна. Проявляет окислительные свойства.
2 группа Физические свойства оксидов
I СО
Газ без цвета, без запаха (почувствовать его невозможно) — тем и коварен! Этот газ коварен еще и тем, что распределяется в воздухе равномерно. Мr (СО) = 28 и приблизительно равна Мr (воздуха) = 29 В воде нерастворим. Горит голубоватым пламенем. Ядовит, ПДК (СО) = 20 мг/м3Соединяясь с гемоглобином красных кровяных телец, переносчиков кислорода от легких к тканям организма, угарный газ вызывает кислородное голодание, и человек может погибнуть. При вдыхании воздуха, содержащего до 0,1% CO человек может потерять сознание и умереть. При отравлении наблюдается резкая потеря сознания, в тяжелых случаях — смерть. Угарный газ необратимо связывается с гемоглобином крови, препятствуя газообмену, человек — задыхается. Оказание помощи — дышать чистым кислородом, переливание крови. Где же можно встретить такого “монстра”? Наблюдать его можно в пламени свечи, топке. Присутствует он и в выхлопных газах двигателей внутреннего сгорания, и в сигаретном дыме. Образуется при сгорании большинства горючих материалов в условиях ограниченного доступа воздуха.
II СО2
Газ без цвета, без запаха, хорошо растворим в воде, Мr(СО2) = 44. Сравним с Мr(воздуха) = 29. В 1,5 раза тяжелее воздуха. При t = - 760С – сухой лёд.
Оказывает на человека наркотическое действие, раздражает кожу и слизистые оболочки, оказывает центральное сосудосуживающее и местное сосудорасширяющее действие, вызывает повышение содержания аминокислот в крови, ингибирует действие ферментов в тканях. ПДК (СО2) = 30 мг/м3 Для человека вреден как избыток его, так и недостаток. В небольших количествах (до 2%) углекислый газ стимулирует деятельность дыхательного центра. С увеличением концентрации возникают серьёзные расстройства, и при 10%-й концентрации дыхание останавливается, происходит потеря сознания, при 20% - паралич жизненных центров в течение нескольких секунд. К счастью, человек редко сталкивается с такими большими концентрациями СО2 в воздухе ( это возможно, например, в подвалах без вентиляции, где хранят сухой лёд).
Как помочь человеку, отравившемуся углекислым газом? — вывести на свежий воздух.
3 группа Химические свойства оксидов
I СО - горючий газ, горит голубым пламенем:
2CO +O2 = 2CO2 (углекислый газ) +577 кдж
CO +Cl2 =COCl2 (фосген)
Оксид углерода (II) может восстановить большинство металлов из их оксидов, например:
CO + СuО —> Сu+ CO2
CO +FeO =CO2 +Fe
СO +2H2 =CH3 OH (метанол)
II Углекислый газ – кислотный оксид, он взаимодействует с основными оксидами и основаниями с образованием кислых и средних солей, с некоторыми солями, водой:
CaО+ CO2 —> CaCO3
Ca(OH)2+ CO2 —> CaCO3 + H2O (качественная реакция на CO2)
Ca(OH)2+ 2CO2 —> Ca(HCO3)2
СаСО3 + СО2 + Н2О —> Са(НСО3)2
СО2 + Н2О = Н2СО3
СО2 – окислитель
а) СО2 + С = 2СО
б)Магний способен гореть в атмосфере CO2, восстанавливая при этом углерод.
2Mg + CO2 —> 2MgO+ C (5000C)
Не тушите загоревшуюся пиротехнику углекислотным огнетушителем!
Пероксид натрия поглощает углекислый газ:
2Na2O2 + 2CO2 —> 2Na2CO3+O2^
Это реакцию используют в подводных лодках и в космических кораблях для регенерации воздуха.
Огромная масса углекислого газа превращается в органические вещества и кислород в результате фотосинтеза:
6CO2 + 6H2O —> C6H12O6 + 6O2^
4 группа Получение оксидов и применение
I CO
1. В промышленности С + О2 = 2СО
2. В лаборатории НСООН = Н2О + СО^
II CO2
1. В промышленности СаСО3 = СаО + СО2^
2. В лаборатории СаСО3+2НСl=СаСl2+СО2^+Н2О
Применение оксидов
I СО
1) Топливо.
2) Основная часть генераторного газа – одного из видов газообразного топлива.
3) Как восстановитель в металлургии.
4) Исходное вещество при синтезе органических веществ.
5) Применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и свежий вид, не изменяя вкуса
6) Недавно выяснилось, что угарный газ может уменьшить поражение мозга при инсульте: по результатам исследований на мышах ученые установили, что лечение малыми дозами угарного газа может помочь ограничить повреждение головного мозга.
II СО2
1) В производстве сахара, соды, газированных напитков;
2) Не поддерживает жизнедеятельность бактерий и плесени – в его атмосфере сохраняют продукты. Сухой лёд – для хранения продуктов.
3) В жидком виде – в огнетушителях;
4. Закрепление знаний и способов действий
Представители каждой группы освещают свой вопрос. Остальные слушают, заносят материал в таблицу, задают вопросы
5. Обобщение и систематизация знаний.
Учитель: давайте обобщение проведем в практическом применение полученных знаний
1. В вулканической зоне близ Неаполя находится “собачья пещера”. Страшная тайна долгое время будоражила воображение местного населения. Ответим на вопрос, прозвучавший в начале урока.
2. Лаборант нашей школы не уважает углекислый газ за то, что из-за него баночки с растворами щелочей невозможно открыть после школьных каникул. Объясните — почему лаборант обвиняет в этом углекислый газ?
3. Проблема очищения воздуха от углекислого газа на космических станциях и подводных лодках — больная проблема. Еще писатель-фантаст Ж. Верн пытался решить ее. А какой выход нашли современные ученые?
4. Шумная компания городских жителей решила отметить Новый год на природе, в деревенском домике с печкой. Когда дрова прогорели, они закрыли вьюшку у печки, не заглянув вовнутрь, чтобы, как они решили, тепло сохранилось дольше. Что могло случиться, но, к счастью, не произошло, так как дверь в домике очень часто была открыта?
5. Водитель, нарушая привычные для себя правила, заехал в гараж задним ходом, чтобы утром быстрее выехать. Но утром было очень холодно и водитель, не открыв ворота, решил прогреть двигатель. Через некоторое время случилось непредвиденное...
6. Основной вопрос урока “Оксиды углерода – друзья или враги?”
7. Объясните выражение: “Угорел в избе (бане)”.
8. Установите признак, объединяющий указанные объекты

9. Провести качественный анализ шипучих прохладительных напитков на содержание углекислого газа.
а. Собрать прибор для получения газов.
б.Определителем наличия углекислого газа является известковая вода.
в.Осторожно нагреть напиток, пропуская образующийся газ через известковую воду.
г. Наблюдается помутнение известковой воды. Образуется осадок белого цвета.
10. Известно, что при прохождении технического осмотра автомобиля водитель предоставляет справку о состоянии выхлопных газов автомобиля. Концентрация какого газа указывается в справке?
11. В большую открытую ёмкость поместили свечу и зажгли её (рис.1).
Свеча горела нормально. Затем по краю сосуда поместили кольцо из ваты и подожгли его.
Вата загорелась, и через несколько секунд свеча погасла (рис. 2). Объясните происходящее.

Рис. 1 Рис. 2
12. У вас есть все необходимое для проведения качественной реакции на оксид углерода (IV). Проделайте эту реакцию.
6. Закрепление знаний
“Пятый лишний”
У четырех веществ можно найти что-то общее, а пятое вещество выбивается из ряда, лишнее. Найдите это вещество.
1. Углерод, алмаз, графит, карбид, карбин.
2. Антрацит, торф, кокс, нефть, стекло.
3. Известняк, мел, мрамор, малахит, кальцит.
4. Кристаллическая сода, мрамор, поташ, каустик, малахит.
5. Фосген, фосфин, синильная кислота, цианид калия, сероуглерод
6. Морская вода, минеральная вода, дистиллированная вода, грунтовая вода, жесткая вода.
7. Известковое молоко, пушонка, гашеная известь, известняк, известковая вода.
8. Li2СО3; (NH4)2CO3; СаСО3; K2CO3, Na2CO3.
“Синонимы”
Напишите химические формулы веществ или их названия.
1. Генераторный газ-....
2. Парниковый газ – ...
3. Несолеобразующий оксид- .....
4. Соединение СО с гемоглобином – ...
5. Реактив на СО2 – ...
6. “ Сухой лед” – ...
7. Компонент выхлопных газов автомобиля-.....
8. Условно ядовитый газ-.....
9. Природный газ – ...
“Антонимы”
Напишите химические термины, противоположные по значению предложенным.
1. Окислитель – ...
2. Донор электронов – ...
3. Кислотные свойства – ...
4. Ковалентная полярная связь – ...
5. Адсорбция – ...
6. Избыток – ...
7. Анион – .....
8. Металл – ...
9. Исходные вещества – ...
“Поиск закономерностей”
Установите признак, объединяющий указанные вещества и явления.
1. Алмаз, карбин, графит – ...
2. Стекло, цемент, кирпич – ...
3. Дыхание, гниение, извержение вулкана – ...
4. СО, NO, N2O- ...
5. NaHCO3,СО, CaCO3, CO2, H2CO3 – ...
“Крестики и нолики”. Определить выигрышные пути:
Вещества, с которыми взаимодействует оксид углерода (IV)
HCl Ca H2 H2O KOH ВаО O2 CaCO3 CuO
Вещества, имеющие одинаковое значение степени окисления углерода:
CO2 СО CaC2 H2CO3 CH4 Na2CO3 Na2CO3 Al4C3 C2H6
7. Подведение итогов
Что мы сегодня изучили на уроке и ответили ли на главный вопрос: оксиды углерода – друзья или враги?
8. Рефлексия
На уроке
- Я узнал(а)....
- Я научился....
- Я почувствовал, что.....
- Мне это пригодится в жизни ...
- На уроке я работал(а) .....
- Цели урока достиг(ла) .....
- Я получил(а) оценку-.........
9. Информация о домашнем задании
Дома посмотрите содержимое аптечки, ванной комнаты, кухни и найдите предметы бытовой химии, содержащие в своём составе СО2 и другие соединения углерода. Заполнить таблицу до конца. П.30.
Благодарю вас за урок и те знания, которые вы сегодня показали. И пусть по жизни вас ведет мудрая русская поговорка: “Не стыдно не знать, стыдно не учить”. Урок окончен. До свидания!
























