Задачи.
- Познакомить учащихся с сущностью окислительно-восстановительных процессов, объяснить закономерности процесса окисления-восстановления.
- Стимулировать познавательную активность школьников, развивать интерес к предмету, эрудицию, умение быстро и чётко формулировать свои мысли, логически рассуждать.
Оборудование. Компьютер, проектор, у каждого учащегося на столе распечатка с сеткой урока (изучение нового материала и закрепление изученного материала).
ХОД УРОКА
I. Проверка знаний
1) Работа у доски по карточкам (3 учащихся):
| Карточка 1. Определи степень окисления каждого химического элемента в следующих соединениях: KCl, KClO3, MgCl2, Cl2, KMnO4, K2MnO4, H3PO4. Назови вещества. |
| Карточка 2. Определи степени окисления каждого химического элемента в следующих соединениях: серная кислота, гидроксид натрия, азот, сульфат калия, хлорид железа (III), оксид алюминия, аммиак. |
| Карточка 3. Определи степени окисления каждого химического элемента в сложных ионах: NH4+, SO42–, HCO3–, NO3–, HPO42–, HS–, ClO4–. |
2) Работа с классом. Используя знания степеней окисления, найдите «лишнего». Назовите каждое вещество.
Ca(NO3)2 |
KNO2 |
Mg3N2 |
KClO3 |
Cl2O7 |
HCl |
H2S |
H2SO3 |
H2S |
II. Изучение нового материала
1) Определи степени окисления элементов в реагентах и продуктах реакций.
| Окислительно-восстановительные реакции | Реакции, не являющиеся окислительно-восстановительными |
| 1. Mg + H2SO4 = MgSO4 + H2 2. 2 + O2 = 2H2O |
1. CaCO3 = CaO + CO2 2. 2O3 = 3O2 |
2) Подчеркни реакции, протекающие с изменением степени окисления. Как называются такие реакции?
| Окислительно-восстановительные реакции – реакции, .................................................................................................................... |
В ходе реакции степени окисления элементов,
входящих в состав исходных и конечных веществ,
могут либо оставаться постоянными, либо
изменяться. В последнем случае реакции
называются окислительно-восстановительными и
осуществляются за счёт перераспределения
электронной плотности, а иногда и полного
перехода одного или нескольких электронов между
атомами реагентов, что проявляется в изменении
степени окисления соответствующих элементов.
Окислительно-восстановительные реакции крайне
многочисленны и многообразны. Они постоянно
происходят в природе в виде процессов,
поддерживающих жизнедеятельность организмов, в
виде горения, гниения, коррозии и т. д. получение
металлов из руд, производство лекарственных
препаратов, выработка энергии и многие другие
задачи производственной деятельности человека
решаются на основе использования реакций
окисления-восстановления.
На шкале представлены значения степени
окисления. Стрелками укажи направление их
изменения для Mg и H.
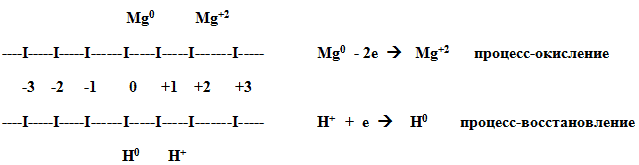
| Процесс отдачи электронов называется
................................................................. Процесс присоединения электронов называется .................................................... |
Окислитель (Ох, от англ. Oxidant) –
вещество, которое окисляет другие вещества.
Восстановитель (Red, от англ. Reductant)-
вещество, которое восстанавливает другие
вещества.
Закончи описание анализируемой реакции:
- Окисляется ......., значит окислителем является ......., который электроны..............
- Восстанавливается ......., значит восстановителем является ......., который электроны ....... ....... .
| Частица, принимающая электроны,
называется ................................................... Частица, отдающая электроны, называется .............................................................. |
3) Отметь на схеме стрелкой направление перехода электронов в ОВР.
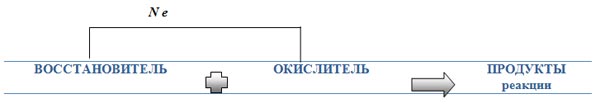
Если одна частица отдаёт электроны, то другая их приобретает. Именно поэтому окисление и восстановление в химических системах всегда происходит одновременно. Однако часто удобно рассматривать их как отдельные процессы. Уравнения, описывающие только окисление или только восстановление, называются полуреакциями или электронными уравнениями.
III. Закрепление изученного материала
4) Закончи уравнения полуреакций. Назови процесс, укажи, окислителем или восстановителем является исходная частица.
Схема |
Процесс | Ох/Red | Схема |
Процесс |
Ох/Red |
| Cu0 – 2e = Cu+2 | Fe0 e = Fe+3 | ||||
| Cr0 e = Cr+6 | Sn0 e = Sn+4 | ||||
| P0 e = P–3 | S0 e = S–2 | ||||
| I0 e = I– | C0 e = C–4 | ||||
| Cl+7 + 7e = | Se+6 + 4e = | ||||
| H+ + 1e = | Na0 – 1e = | ||||
| O–2 – 2e = | Pb+4 + 2e = |
IV. Подведение итогов урока
Просмотр видеофрагмента «ОВР»
Выставление оценок.
Домашнее задание.
Литература.
- Дерябина Н.Е. Общая химия. Часть II. – М.: МГУ. 2003.
- Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии. – М.: Школьная пресса. 2002.