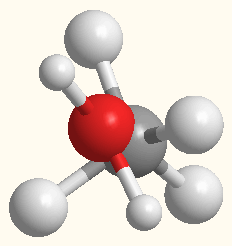
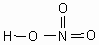Эпиграф “Ум заключается не только в знании, но и в умении прилагать знание на деле”. (Аристотель).
Цель: Создать условия для обобщения и систематизации знаний учащихся по теме “Первоначальные химические понятия”.
Тип урока: урок обобщения и систематизации знаний.
Планируемые результаты:
Личностные:
- Создание условий для развития познавательной деятельности, активности, самостоятельности;
- Формирование потребностей в ценностном отношении к знаниям;
- воспитание культуры общения через работу в парах “ученик-ученик”, “учитель-ученик”;
- прослеживание связи науки химии с окружающим нас миром;
Метапредметные:
- развитие умения: анализировать ответы товарищей, прогнозировать результат работы, оценивать свою работу;
- создание условий для обучения умениям:
- анализировать, обобщать информацию ;
- сравнивать вещества простые и сложные;
- отвечать на вопросы разного типа;
- согласованно работать в парах, группе;
- осуществлять самоконтроль, взаимоконтроль, взаимопомощь;
- продолжить формирование навыков:
- планирования и проведения химического эксперимент;
- освоения языка химической науки;
Предметные:
- создать условия для закрепления, обобщения и систематизации знаний по теме “Первоначальные химические понятия”.
1).закрепить понятия:
- простое и сложное вещества;
- валентность;
- химическая формула вещества;
- уравнение химической реакции;
- относительная молекулярная масса вещества;
- массовая доля хим. элемента в веществе;
2).закрепить навыки:
- составления химических формул вещества;
- определения валентности хим. элемента по хим. формуле вещества;
- составления уравнений химических реакций;
- решения расчетных задач по формулам веществ.
Модель урока
| Этапы урока | Основные дидактические задачи | Формы организации деятельности учащихся | Методы обучения и приемы обучения | Средства обучения | Примерное время (мин). |
| организационный | Подготовка к работе: организация | коллективная | Беседа | – | 1 |
| Этап актуализа-ции знаний и мотивация. | коллективная | Мотивационная беседа | тетрадь | 1 | |
| Этап подготовки к работе на основном этапе | Создать условия для актуализации понятий: химический элемент, простое и сложное вещество, хим. формула, уравнение химической реакции, относительная масса в-ва, массовая доля хим.элемента в в-ве. | коллективная | Фронтальная беседа. | Рабочая тетрадь, таблица химических элементов ПС. | 8 |
| Этап обобщения и систематизации | Создать условия для усвоения понятий и выработки умений с учетом индивидуаль-ных способностей уча-щихся в ходе обучения химической термино- логии, изготовления моделей, проведения хим. эксперимента. | В группах постоянного сос- тава, в команде, коллективная. | 1).Выполнение дидактических зада-
ний 1,2,5,6,7; 2).Изготовление шаростержневых моделей (дид.зад.№3) 3).выполнение химического экспе- римента (дид.зад.№4) 3) беседа, ответы на вопросы. |
Оборудование кабинета химии, набор шаростержневых моделей, компьютерная презентация. | 25 |
| Этап контроля и самоконтроля знаний и умений. | – | Работа в парах постоянного состава | Выполнение заданий на понимание и сравнение | Использование ЦОРов | 5 |
| Этап информации о домашнем задании. | Показать связь химии с окружающим нас миром. | коллективная | Нахождение информации и выполнение творческой работы. | – | 2 |
| Этап рефлексии. | Дать качественную оценку работы учащихся. | коллективная | 3 |
Ход урока
| Действия учителя | Действия ученика |
| 1. Организационный этап. | |
| В начале урока хочу обратить ваше
внимание на эпиграф: “Ум заключается не только в знании, но и в умении прилагать знание на деле”. (Аристотель). Прочтите его. Как вы его понимаете? Я предлагаю обдумать его и проверить справедливость этих слов в течение нашего урока. |
Ответы учащихся могут быть разными. |
| 2. Этап актуализации знаний и мотивация. | |
| Сформулируем тему сегодняшнего урока. Запишем тему урока в рабочую тетрадь: “Первоначальные химические понятия”. Мы сегодня вспомним и обобщим все те знания, которые успели получить за время изучения химии. И начнем со сравнений. Попытаемся сегодня сравнить химию с русским языком. Как по-вашему, есть между этими науками сходство? |
Ответы учащихся могут быть разными. |
| 3. Этап подготовки к работе на основном этапе. | |
| Придя в первый класс, вы начали изучать буквы русского языка. Сколько их? | В русском алфавите 31 буква. |
| В химии тоже есть свои буквы. Как вы думаете, что мы называем буквами в химии? | В химии буквами называют химические элементы. |
| А что называется химическим элементом? | Слайд Это один определенный вид атомов. |
| Но у химического элемента название более длинное, чем буквы и звуки в русском языке. Как по-вашему, даются названия хим. элементам? | В честь ученых, которые внесли большой вклад в развитие химии, в честь планет, государств и др. |
| Буквы русского алфавита соединяются между собой и образуются слова. А как вы думаете, в химии есть слова? Что является словами в химии? | Это формулы. Формула – это условная запись состава вещества с помощью химических символов и индексов. |
| А на что показывает индекс? | Индекс показывает на количество атомов хим. элемента в веществе. |
| В химии атомы хим. элементов соединяются между собой в определенном порядке или как угодно? | В определенном порядке. |
| А что является этим порядком? | Валентность. |
| Что такое валентность? | Валентность – это способность атомов одного химического элемента присоединять к себе определенное число атомов другого хим. элемента. |
| 4. Этап обобщения и систематизации знаний. | |
| Дидактические задания № 1. | |
| Давайте составим с вами несколько химических формул: NaO; PO; SO; HS | Na2O;P2O5; SO3;; H2S Слайд |
| Но бывает, что надо определить валентность хим. элемента по формуле. Давайте с вами определим валентность каждого хим. элемента в следующих формулах. | Дидактическое задание № 2. CaO; Mn2O7; FeCl3; Слайд |
| Это все молекулярные формулы. А какие еще вы знаете формулы? | Структурные. Слайд. |
| А это что за формулы? | Это формулы, которые показывают порядок соединения атомов в молекуле и валентность каждого хим. элемента. |
| На доске вы видите молекулярные формулы
некоторых веществ. Изобразите для них формулы
графические: H2O; CO2; Mn2O7; HNO3;
CH4; А теперь, после того как вы их нарисовали, давайте эти формулы представим в виде шаростержневых моделей. Для этой работы у вас на партах лежат наборы: один шарик-это один атом, а одна трубка-это одна валентность. Предложите ваши варианты возможных моделей (Попробуйте спрогнозировать, предположить строение данных веществ). Что вы будете учитывать при моделировании? Сформулируйте основные положения ваших прогнозов. Работа проводится в парах постоянного состава. |
Слайд. Дидактическое задание № 3.
|
| В русском языке слова соединяются и образуются ........... ЧТО? | Предложения. |
| А какие бывают предложения? | Повествовательные, вопросительные, восклицательные. |
| А в химии что является предложениями? | Уравнения химических реакций. |
| Что называется уравнением химической реакции? | Это условная запись уравнения реакции с помощью формул и коэффициентов. |
| Какие типы реакций вы знаете? | Реакции соединения, разложения, замещения. |
| Какие реакции называются реакциями соединения, разложения, замещения? | Реакция соединения – это реакция, в
результате которой из двух или нескольких
веществ образуется только одно, более сложное
вещество; Реакция разложения – это реакция, в результате которой из одного сложного вещества образуется два или несколько более простых веществ. Реакция замещения – это реакция, протекающая между простым и сложным веществами с образованием другого простого и другого сложного веществ, где атомы простого вещества замещают атомы в сложном веществе. |
| Выберите, пожалуйста, из написанных на
доске реакций: 1) Реакции соединения; 2) Реакции разложения; 3) Реакции замещения; Закончите их, расставьте коэффициенты, назовите продукты реакций (простое или сложное вещество). На партах у вас стоят реактивы. Проведите эксперимент для реакций №1 и №4. Реактивы: медная проволока, железная скрепка или кнопка, раствор хлорида меди(ll), спиртовка. За работой уч-ся наблюдает учитель, он же осуществляет проверку работы. Работа проводится в парах постоянного состава. |
Слайд. Дидактическое задание № 4. 1). Cu + O2 —> ? 2).H2O —> ? + ? 3). P + O2 —> ? 4). Fe + CuCl2 —> ? + ? 5). HI —> ? + ? Учащиеся проводят реакции №1 и №4 (окисление медной проволоки и восстановление меди). При этом повторяют правила по технике безопасности при работе с химическими реактивами и нагреванием. |
| Согласно какому закону мы составляем уравнения химических реакций? | Согласно закону сохранения массы вещества. |
| Как читается этот закон? | Массы веществ, вступающих в реакцию, должны равняться массе веществ, образованных в результате реакции. |
| Кто открыл этот закон? | Слайд М.В.Ломоносов. |
| А что вы можете рассказать о выдающемся
ученом-поэте М.В.Ломоносове? Заранее уч-ся предлагается побольше узнать об этом человеке. |
Гениальный русский ученый (химия, физика, астрономия...), поэт, просветитель, один из самых выдающихся светил русской науки... |
| Дидактическое задание № 5. | |
| Теперь мы с вами пришли к выводу, что все
вещества обладают массой: и простые вещества, и
сложные вещества. На данном цветике-семицветике написаны формулы простых и сложных веществ. Давайте сначала сорвем лепесточки простых веществ, а затем – сложных веществ и занесем в таблицу (смотри Приложение 2). |
На лепестках напишите формулы простых и
сложных веществ и прикрепите их на доску. Работу
эту можно проводить в командах (по рядам). Например: CH4, O2. CS2. N2, H2O, O3, MgS, P4, HNO3 Al. Лепестки затем прикрепляют в нужную колонку таблицы.
|
| Дидактическое задание № 6. | |
| Если каждое вещество обладает массой, то ее можно посчитать. Рассчитайте относительную молекулярную массу следующих веществ: N2O5, Al2O3. | Mr(N2O5) = 2Ar(N) + 5Ar(O)
= 2*14 +5*16 = 108 Mr(Al2O3) = 2Ar(Al) + 3Ar(O) = 2*27 + 3*16 = 102 Слайд. Слайд (обобщение) №1. |
| Теперь давайте проверим ваши ответы. Для этого обменяйтесь вашими тетрадями. | Уч-ся проверяют друг у друга расчеты, сверяясь с доской (работа в парах постоянного состава). |
| Зная, как считать относительную молекулярную массу в-ва, мы можем делать различные расчеты. И вот пример: | Слайд. Wв-ва = Ar( Э) *n/Mr в-ва |
| Вам принесли два образца разных
метеоритов, упавших на Землю в разное время. Один из метеоритов – Сихотэ-Алинский железный метеорит.
[29] Сихотэм-Алимнский метеоримт — железистый метеорит массой 23 тонны, часть метеоритного дождя, общая масса осколков которого оценивается в 60—100 тонн. Входит в десятку крупнейших метеоритов мира, упал 12 февраля 1947 года на Дальнем Востоке (Россия). Исследования показали на следующий состав: 1). Сихотэ-Алинского метеорита: 5 атомов кобальта, 97 атомов никеля и 1679 атомов железа. 2).метеорита Фукан: Mg2Fe3 NiSiO4. Рассчитайте, какой метеорит более богат железом? Что для этого надо рассчитать? |
Другой метеорит – метеорит Фукан,
относится к одному из самых редких типов
метеоритов – палласитам. Чаще всего такие
метеориты на 50% состоят из железно-никелевой
основы и на 50% из оливина (хризолита), который
иногда называют космическим драгоценным камнем.
Единственным и неповторимым в своем роде Фукан
делает то, что его украшают огромные куски
кристаллизовавшегося оливина, на которые
приходится большая часть его массы.
[28]Возраст данного метеорита по оценкам экспертов составляет без малого 4,5 миллиардов лет, что, по сути, делает его ровесником нашей планеты, которая сформировалась из Солнечной туманности 4,54 миллиардов лет назад. Этот метеорит был обнаружен в 2000 году вблизи города Фукан (Китай). Весит 419,57 кг. Чтобы ответить на этот вопрос, надо рассчитать массовую долю железа в метеорите. Слайд. Дидактическое задание № 7. 1).Mr(С-А метеорита) = 5*59 + 97*59 +1679*56 =100042 W(Fe) = 1679*56/100042 = 0,94=94% 2).Mr(Mg2Fe3NiSiO4) = 24*2 + 56*3 + 59 + 28+16*4 = 367 W(Fe) = 56*3/367 = 0,46 = 46% Железом богаче будем Сихотэ-Алинский метеорит. |
| 5. Этап контроля и самоконтроля знаний и умений. | |
| “Деятельность — единственный путь к знанию”. Б.Шоу. | Рекомендуется использовать ЦОРы [30] к
учебнику “Химия” Габриеляна О.С. 8 класс, Раздел:
химическая формула. Относительная атомная и
молекулярная массы. В данном разделе: №5
“Сравнение относительной молекулярной массы
в-ва”, №7 “Химическая формула. Коэффициенты”.
Интерактив. (Не важно, по какому учебнику Вы
работаете). Учащиеся выполняют работу и на понимание, и на сравнение. |
| 6. Этап информации о домашнем задании. | |
| 15 февраля 2013 года над Челябинском пролетел метеорит. Что вы знаете об этом явлении? Найдите интересную информацию и систематизируйте ее. | Используется Интернет, газеты, журналы
и др. СМИ. Для желающих: можно сделать творческую работу или мини-проект. |
| 7. Этап подведения итогов. Рефлексия. | |
| Как вы оценили себя на протяжении всего
урока? Сегодня на уроке мы с вами говорили на
особом языке – языке химии. Многим это удалось.
Обратимся к нашему эпиграфу: “Ум заключается не
только в знании, но и в умении прилагать знание на
деле.” (Аристотель). Пригодились ли вам ваши
знания на деле? Смогли ли вы их применить в
конкретном случае? Спасибо всем за работу! |
|