Тип мероприятия. Мастер-класс с элементами закрепления знаний, с проведением демонстрационного эксперимента и лабораторной работы.
Цель: в развлекательной форме обобщить знания по химии; стимулировать чтение научно-популярной литературы, познакомить с необычными фактами, способствовать развитию логики, мышления, сообразительности, находчивости; прививать интерес к химии.
Оборудование:
1. Дидактический раздаточный материал для
каждого обучающегося.
2. Лабораторное оборудование: эксикатор, в
стаканчике, пипетки, спиртовка, спички, ложка для
сжигания веществ, асбестовая сетка,
металлический поднос, пробиркодержатель,
стеклянные стаканчики, колба стеклянная,
трёхлитровая банка,
3. Реактивы: порошок алюминия, кристаллический
йод, вода, перманганат калия, дихромат аммония,
спирт этиловый, магний металлический, магниевая
лента, концентрированная и разбавленная
соляная кислота, мрамор, растворы солей бромида
калия и йодида калия в стаканчиках,
гидроксида натрия, кристаллический йод,
фенолфталеин, растворы слей NiSO4, CoCl2,
CrCl3, Pb(NO3)2 и т.д.
Этапы занятия:
1. Актуализация знаний
– Мы приветствуем всех, кто пришёл сегодня в
гости к нам. А начать хочется словами
Дистервега: «Не в количестве знаний
заключается образование, а в полном понимании и
искусном применении всего того, что знаешь».
Существует большое количество признаков, по
которым можно классифицировать химические
реакции.
Сегодня мы уделим внимание классификации по
числу и составу реагирующих и образующихся
веществ. Для начала вспомним, какие типы реакций
вы знаете? Обучающиеся изучают первый пункт
дидактического раздаточного материала.
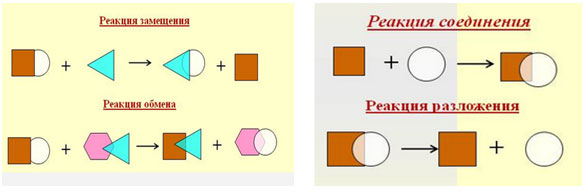
Занятие у нас необычное тем, что какие-то реакции мы увидим в ходе демонстрационного эксперимента, а какие-то вы проделаете сами.
2. Проведение демонстрационного и лабораторного эксперимента
«Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции». М.В. Ломоносов
Обратимся к опытам.
Условия таковы, ваша задача определить, к какому
типу реакций они относятся:
Блок опытов №1. Реакции обмена (лабораторный и демонстрационный эксперимент).
В пронумерованных пробирках на столах в штативах налиты растворы
1) NiSO4, 2) CoCl2, 3) CrCl3, 4) Pb(NO3)2
Добавим в пробирки 1, 2, 3 раствор щелочи, а в пробирку 4 раствор KI.
1) NiSO4 + 2KOH = Ni(OH)2 + K2SO4,
2) CoCl2 + 2KOH = Co(OH)2 + 2KCl,
3) CrCl3 + 3KOH = Cr(OH)3 + 3KCl,
4) Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Демонстрируем колбу с перекристаллизованным PbI2.
Одновременно демонстрируем опыты, используя
большие объёмы (мерные цилиндры на 500 мл).
Обсуждение результата опытов, составление
уравнений проведённых реакций.
Блок опытов № 2. Реакции соединения (демонстрационный эксперимент).
1) Горение струны в чистом кислороде.
| Заранее собираем в большую толстостенную банку кислород методом вытеснения воды. Способом разложения перманганата калия. |
Берём кусок тонкой струны, обматываем ею неплотно ложечку для сжигания веществ, вставляем между проволокой запал головки спички, накаливаем в пламени спиртовки струну и вносим в банку с чистым кислородом. Железо сгорает, образуя сноп искр.
3Fe (струна) + 2О2 = Fe3O4
2) Горение магниевой ленты.
| Заранее нарезаем полоски фильтровальной бумаги и наклеиваем на них с помощью канцелярского клея порошок магния. Магниевые ленты просушиваем. |
Зажимаем в пробиркодержатель магниевую ленту и поджигаем её от спиртовки.
2Mg + O2 = 2MgO
3) Взаимодействие алюминия с йодом.
| Готовим эксикатор. На дно эксикатора ставим
фарфоровую ступку, в неё насыпаем порошок
алюминия (лучше опыт проходит с «серебрянкой») и столько же растёртого в порошок кристаллического йода. |
К смеси добавляем пипеткой несколько капель воды и ждём 1-2 минуты. Как только начинается обильное выделение фиолетовых и тёмно-бурых паров, накрываем эксикатор крышкой.
2Al + 3I2 = 2AlI3 (H2O – катализатор)
Обсуждение результата опытов, составление уравнений проведённых реакций.
Блок опытов № 3. Реакции разложения (демонстрационный эксперимент).
1) Опыт «Вулкан»
| Заранее готовим металлический поднос, на него
кладём асбестовую сетку, на неё насыпаем горкой
дихромат аммония, в центре делаем небольшое
углубление, в которое насыпаем немного порошка магния. |
Непосредственно перед проведением опыта капаем несколько капель спирта и поджигаем спичкой, чтобы быстрее начался процесс.
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
2) Содовая гадюка
| В Столовую тарелку насыпаем 3-4 чайные ложки
сухого просеянного речного песка и делаем из
него горку с углублением в вершине. Затем готовим реакционную смесь, состоящую из 1 чайной ложки сахарной пудры и 1/4 чайной ложки гидрокарбоната натрия. Пропитываем песок спиртом 96% -ным и засыпаем в углубление реакционную смесь, а после этого поджигаем спирт. Через 3-4 минуты на поверхности смеси появляются чёрные шарики, а у основания горки – чёрная жидкость. Когда почти весь спирт сгорит, смесь чернеет и из песка медленно выползает извивающаяся толстая черная «гадюка». У основания она окружена «воротником» догорающего спирта. Чем дольше горит спирт, тем длиннее получается «змея», состоящая из карбоната натрия, смешанного с мельчайшими частичками угля, который образуется при окислении сахара. |
2NaHCO3 = Na2CO3 + H2O↑ + CO2↑
3) Зелёная сладкая змейка
| Смешиваем 1г дихромата аммония (NH4)2Cr2O7,
2 г нитрата аммония NH4NO3 и 1 г сахарной
пудры. Эту смесь смачиваем водой, лепим из неё палочку и сушим на воздухе. При поджигании палочки «ползут» черно-зелёные змеи. |
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4NO3 = N2O + 2H2O
C12H22O11 + 6O2 = 6CO2 + 11H2O + 6C
Блок опытов № 4. Реакции замещения (демонстрационный и лабораторный эксперимент).
1) «Ежики» (лабораторный эксперимент)
На столах обучающихся склянки с раствором нитрата свинца и гранулы цинка. В чистую пробирку просим поместить 2-3 гранулы цинка и прилить раствор нитрата свинца. Через 2-3 минуты наблюдаем образование свинцовых «ёжиков».
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
2) Горение магния в атмосфере углекислого газа (демонстрационный эксперимент).
| Заранее заполняем банку углекислым газом. Для
этого используем мрамор и раствор соляной
кислоты. Проверяем наличие углекислого газа горящей лучинкой (она должна потухнуть). Вносим раскалённый в пламени спиртовки магний в банку с углекислым газом и наблюдаем, что процесс горения продолжается и образуется сажа. |
2Mg + CO2 = С + 2MgO
3) Получение йода и брома (демонстрационный эксперимент).
| Перед началом занятия на дно трёхлитровой
банки насыпаем немного кристаллического
перманганата калия, наливаем 5-6 мл
концентрированной соляной кислоты HCl, закрываем крышкой плотно. Заранее готовим 2 полоски фильтровальной бумаги. |
Смачиваем одну полоску фильтровальной бумаги раствором йодида калия, а другую раствором бромида калия, вносим их в банку с хлором. Наблюдаем, происходящее.
2KI + Cl2 = 2KCl + I2
2KBr + Cl2 = 2KCl + Br2
4) Взаимодействие натрия с водой (демонстрационный эксперимент).
Готовим кристаллизатор: наполовину заполняем его водой, добавляем несколько капель индикатора – фенолфталеина и бросаем аккуратно маленький кусочек металлического натрия. Обсуждаем то, что происходит в кристаллизаторе.
2Na + 2H2O = 2NaOH + H2
Делаем выводы по данному блоку реакций.
3. Закрепление
Обучающиеся работают по второму пункту раздаточного материала.
реакции соединения |
реакции разложения |
реакции замещения |
реакции ионного обмена |
Задание. Заполните таблицу уравнениями проведённых и увиденных реакций, распределяя их по типам в соответствующий столбец.
Проверяем правильность заполнения таблицы.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах. Например, азотные удобрения, сульфаниламиды и другие синтетические препараты. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Неумелое или безответственное воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов. Что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
А закончить нам хотелось бы словами Льва Николаевича Толстого: «Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не одной памятью».
В ходе занятия вы попытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, то есть проводить исследования. Многие учёные прошлых веков опирались в своих изысканиях лишь на интуицию и в результате нередко ошибались. Мы же с помощью опытов нашли свою истину.
4. Рефлексия
Продолжите фразу:
1. Сегодня я понял …
2. Теперь я могу…
3. Я приобрел….
4. Меня удивило …
5. Я попробую …
6. Мне захотелось…
7. Мне больше всего понравилось …
Литература
- Степин Б.Д. Занимательные задания и эффектные опыты по химии /Б.Д.Степин, Л.Ю. Аликберова. – М.: Дрофа, 2002. – 432с.: ил.– (Познавательно! Занимательно!).
- nsportal.ru/sites/default/files/2012/10/himicheskie_reakcii_0.doc
- http://www.kristallikov.net/page19.html