Урок химии на тему "Катализ". 11-й класс
Скачать презентацию (50.75 МБ)
Цели: Показать влияние на скорость химических реакций такого явления как катализ. Рассмотреть классификацию химических реакций по участию катализатора и по фазовому состоянию реагирующих веществ и катализатора.
Требования к уровню подготовки учащихся
Знать и понимать:
- Определения понятий «катализ», «гомогенный катализ», «гетерогенный катализ», «катализаторы», «ферменты», «ингибиторы», «каталитические яды», «промоторы»;
- Примеры гомогенного и гетерогенного катализа;
- Области применения катализаторов, в том числе и ферментов;
Уметь:
- Объяснять зависимость скорости химической реакции от действия катализаторов.
ТСО: персональный компьютер, мультимедийный проектор.
Реактивы и оборудование: чашки Петри, химические цилиндры, химические колбы, керамическая пластина, шпатель, пипетка, лучинка, спиртовка; водный раствор аммиака, сульфат меди (II), жидкое моющее средство, пероксид водорода, дихромат аммония, вода, роданид калия, хлорид железа (III), тиосульфат натрия, хлорид натрия кристаллический, морковный сок, вареная морковь, картофельный сок, вареный картофель, кристаллический йод, порошок алюминия.
Перед уроком можно подготовить карточки с фамилиями учеников данного класса, в присутствии детей перемешать их, а далее можно использовать:
- Взять одну карточку и объявить, что выбрали кандидатуру учащегося, кто в конце урока будет обобщать услышанный материал (имя учащегося объявляется по завершению объяснения темы);
- Можно использовать карточки, если нужно вызвать учащегося для демонстрации опыта, для деления на группы.
Учитель высыпает на керамическую пластину 1г алюминиевого порошка и 4г тонко растертого йода конусообразной кучкой. Взаимодействия не происходит. Учитель спрашивает учащихся:
- Процесс взаимодействия этих веществ происходит очень медленно. Верите ли вы, что я смогу увеличить скорость данной реакции?
(Учитель добавляет 2-3 капли катализатора - воды и учащиеся наблюдают появление света и фиолетовых паров йода. Реакция проводится в вытяжном шкафу.)
Запишите реакцию в таблицу. Все реакции, которые будут осуществляться во время урока учителем и учащимися, записываются в данную таблицу.
| № | вещества, вступающие в реакцию | катализатор | вид катализа | уравнение химической реакции | вывод по химической реакции |
Далее учитель предлагает учащимся послушать арабскую притчу «Восемнадцать верблюдов»:
Жил когда-то на Востоке человек, который разводил верблюдов. Всю жизнь он работал, а когда состарился, то позвал к себе сыновей и сказал:
«Дети мои! Я стал стар и немощен и скоро умру. После моей смерти разделите оставшихся верблюдов так, как я вам скажу. Ты, старший сын, работал больше всех - возьми себе половину верблюдов. Ты, средний сын, только начал мне помогать - возьми себе третью часть. А ты, младший, возьми девятую часть».
Прошло время, и старик умер. Тогда сыновья решили разделить наследство так, как завещал им отец. Они выгнали стадо на большое поле, пересчитали, и оказалось, что в стаде всего семнадцать верблюдов. И нельзя было разделить их ни на 2, ни на 3, ни на 9! Что было делать - никто не знал. Стали сыновья спорить, и каждый предлагал своё решение. И они уже устали спорить, но так и не пришли к общему решению.
В это время ехал мимо путник на своём верблюде. Услышав крик и спор, он спросил: «Что случилось?»
И сыновья рассказали о своей беде. Путник слез с верблюда, пустил его в стадо и сказал: «А теперь разделите верблюдов, как велел отец».
И так как верблюдов стало 18, то старший сын взял себе половину, то есть 9, средний - треть, то есть 6 верблюдов, а младший девятую часть, то есть двух верблюдов. И когда они разделили, таким образом, стадо, в поле остался ещё один верблюд, потому что 9+6+2 равно 17.
А путник сел на своего верблюда и поехал дальше.
Какова роль восемнадцатого верблюда? И какая связь этой притчи с темой нашего урока?
В течение урока нам необходимо найти ответы на следующие вопросы:
- Что такое катализатор и каталитические реакции?
- Привести примеры известных вам каталитических реакций из органической и неорганической химии. Указать названия веществ - катализаторов.
- Высказать предположение о механизме действия катализаторов.
- Каково значение каталитической реакции?
В результате обсуждения первого вопроса с учащимися учитель сообщает, что одним из наиболее распространённых в химической практике методов ускорения химических реакций является катализ.
Катализ (от греч. сatalysis - разрушение) - изменение скорости химической реакции при воздействии веществ (катализаторов или ингибиторов), которые участвуют в реакции, но не входят в состав продуктов.
Катализаторы - вещества, повышающие скорость химических реакций, но состав и количество которых в конце реакции остаётся неизменным.
Ингибиторы - вещества, замедляющие скорость химических реакций, но состав и количество которых в конце реакции остаётся неизменным.

(если нет возможности провести демонстрацию опытов, то на слайде есть видеоролики с данными опытами, необходимо кликнуть на розовый прямоугольник )
Примером гомогенного катализа может служить взаимодействие пероксида водрода с сульфатом тетраамминмеди (II).
Демонстрация опыта (приглашается учащийся, выбрать с помощью карточек):
В химический стакан добавляем несколько капель жидкого мыла, далее добавляем 2 мл раствора комплексной соли, а затем приливаем пероксид водорода. Наблюдаем реакцию вспенивания жидкого мыла.
Данную реакцию необходимо зафиксировать в таблицу.
Примером гетерогенного катализа является каталитическое окисление аммиака кислородом воздуха в присутствии оксида хрома (III).
Демонстрация опыта (проводит учитель):
В химическую колбу ёмкостью 500 мл помещаем раствор аммиака и закрываем пробкой. На спиртовке нагреваем дихромат аммония, затем помещаем в колбу с аммиаком. Наблюдаем реакцию «звёздный дождь».
Опыт фиксируем в таблицу.
Как вы думаете, как же катализаторы работают? Вспомните притчу о
восемнадцати верблюдах. (Учащиеся предлагают различные гипотезы)
Лабораторные опыты выполняются учащимися, но на слайдах описан порядок действий:
-
В стаканчик с 3 мл воды добавляют по 1 капле растворов роданида кали и хлорида железа (III). Образующийся раствор красного цвета наливают в 2 пробирки, заполняя их поровну. В две другие пробирки по 2 мл тиосульфата натрия и в одну из них добавляют 2 капли раствора сульфата меди (II) - катализатора. Далее учащиеся проводят две реакции:
а) к раствору роданида железа (III) добавить раствор тиосульфата натрия,
б) к раствору роданида железа (III) добавить раствор тиосульфата натрия и 2 капли сульфата меди (II) -
Наливают в две пробирки по 2 мл раствора сульфата меди (II) и помещают в каждую по грануле алюминия. В одну из пробирок добавляют несколько кристаллов катализатора - поваренной соли.
(Записать уравнения реакций в таблицу)
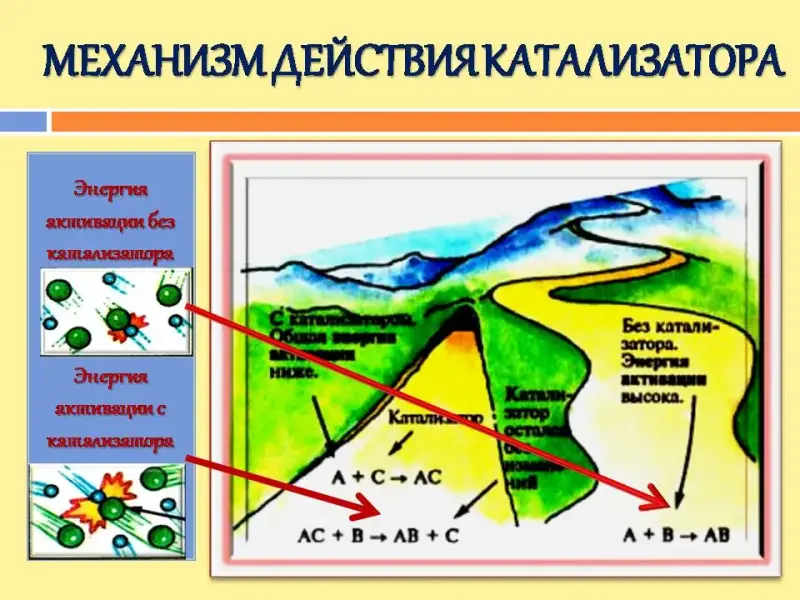
Механизм действия катализатора:
По результатам исследований, что можно сказать о том, как работает катализатор?
Современные представления о катализе сводятся к следующему (разумеется, в самом упрощенном варианте). Есть исходные вещества, атомы, образующие исходные молекулы, можно представить так, что в продукте они будут связаны между собой иными, даже более прочными связями. Т.е. внутренняя энергия системы, состоящей из атомов после «перестановки».
Химическая реакция превращения исходных реагентов в продукты могла бы пройти, но что-то мешает. При описании трехмерной энергетической картины каталитической реакции используют такие образы - «долина исходных веществ», «долина продуктов». Между ними - хребет, энергетический барьер. Он не подпускает атомы настолько близко друг к другу, чтобы они могли поменяться местами и образовать новые, более прочные связи. И перепрыгнуть просто так хребет не получается. А катализаторы оказываются теми самыми проводниками, которые позволяют найти необходимый путь - перевал с высотой поменьше. Там, на перевале катализатор образует промежуточный активированный комплекс, один сразу или несколько последовательно, и соединяет, в конце концов, атомы исходных веществ между собой в ином, нужном исследователям сочетании. Потом он позволяет молекулам новых соединений благополучно скатиться в долину продуктов, а сам удаляется, чтобы соединить новые пары, в идеале - оставшись неизменным. В реальности, правда, он оказывается, изрядно подпорчен каталитическими ядами и прочими невзгодами.
Существует ряд теорий, объясняющих механизм действия катализаторов. Для понимания механизма гомогенного катализа предложена теория промежуточных соединений.
Сущность этой теории заключается в том, что если медленно протекающую реакцию А + В → АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
А + К → АК
Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор освобождается:
АК + В → АВ +К
Если теперь оба процесса суммировать, то получим исходное уравнение:
А+В → АВ
После обсуждения третьего вопроса, учащиеся делают вывод с помощью учителя, что катализатор доставляет реагирующим частицам необходимую энергию для эффективных соударений, т.е. катализатор снижает необходимую для реакции энергию активации, предоставляя реагентам альтернативный путь разрушения и образования связей.
Катализаторы обладают определёнными свойствами:
- Катализаторы не создают процесса, а только изменяют его скорость;
- Для обратимых реакций катализаторы не смещают равновесие и не влияют на константу равновесия, а лишь ускоряют процесс достижения равновесного состояния;
- Катализатор снижает необходимую для реакции энергию активации, предоставляя реагентам альтернативный путь разрушения и образования связей;
- Катализаторы обладают избирательностью, т.е. ускоряют только одну из нескольких реакций.
Избирательность катализаторов мы можем пронаблюдать на следующем примере.
| Реагенты | Катализаторы | Продукты |
| СО + Н2 | Со, Ni, Ru | Алканы (преимущественно) |
| Fe | Алкены (преимущественно) | |
| Zn∙CuO, ZnO∙CrO3 | Метанол | |
| ZnO∙CrO3+ щелочь | Высшие спирты | |
| Fe +BeO | Альдегиды и кетоны |
Строгая избирательность и высокая скорость -два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Ферменты отличаются особой специфичностью, каждый из них ускоряет только одну химическую реакцию с выходом 100%. Ингибиторы в живом организме подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением.
Биологические катализаторы - ферменты.
1 группа учащихся:
Лабораторный опыт: В две чашки Петри помещаем перекись водорода, в первую чашку помещаем кусочек вареного картофеля, в другую - картофельный сок.
2 группа учащихся:
Лабораторный опыт: В две чашки Петри помещаем перекись водорода, в первую чашку помещаем кусочек вареной моркови, в другую - морковный сок.
Пероксид водорода - ядовитое вещество, образующееся в клетке в процессе жизнедеятельности. Принимая участие в обезвреживании ряда токсических веществ, оно может вызвать самоотравление (денатурацию белков, в частности, ферментов). Накоплению Н2О2 препятствует фермент каталаза, распространенный в клетках, способных существовать в кислородной атмосфере. Фермент каталаза, расщепляя Н2О2 на воду и кислород, играет защитную роль в клетке. Фермент функционирует с очень большой скоростью, одна его молекула расщепляет за 1с 200 000 молекул Н2О2→2 Н2О + О2
Значение катализа
- С помощью катализатора многие полезные ископаемые можно превратить в полезные синтетические материалы;
- Производство твёрдых жиров, например маргарина, из жидких масел невозможно без катализатора;
- В хлебопечении большое значение имеет фермент амилаза, расщепляющий крахмал, и протеаза, расщепляющий белок. От активности амилазы зависит скорость брожения теста;
- В спиртовой и пивоваренной промышленности источником амилазы может быть солод и микробные препараты;
- В виноделии и ферментации табака большое значение имеет фермент полифенолоксидаза, от активности которого зависят букет и цвет вина и качество табака;
- Некоторые ферменты, например пепсин, применяют в медицине
- Каталитические явления широко распространены в природе: дыхание, усвоение питательных веществ клетками, синтез белков.
Поиск подходящего катализатора для химической реакции - это настоящее искусство. Здесь учитывается все - размеры молекул, их энергия, ориентация в пространстве, доступность, возможный экономический эффект и много других факторов. Неслучайно, большинство катализаторов, используемых в химической промышленности, запатентованы, а многие даже засекречены. Создание нового эффективного катализатора - это серьезное научное открытие, которое часто удостаивается престижных премий. За открытия в области катализа были присуждены семь Нобелевских премий по химии. Американский химик Ричард Зейр считает катализ понятием, «которое наиболее полным образом характеризует суть химии», так как он не только демонстрирует способность веществ к превращениям, но и подчеркивает роль человека в этом процессе, демонстрирует нашу способность управлять окружающим нас миром.
В заключение урока давайте проверим таблицу с каталитическими реакциями, которые мы провели за сегодняшний урок.
(Далее учитель достает карточку с фамилией ученика, которому предлагает на доске составить синквейн, посвященный изученной теме).
Список используемой литературы.
- О. С. Габриелян, Г.Г. Лысова, А.Г. Введенская, Настольная книга учителя. Химия 11 класс часть 1. Москва: - Дрофа, 2003.
- Журнал «Наука и жизнь» №7, 1979. «Как ускоряют химические реакции» к.х.н. Г. Шульгин.
- Ресурсы сети Интернет: school-collection.edu.ru/ и др.