Тип урока: Практическая работа.
Форма урока: Проблемно-диалогическая с применением ИКТ.
Цель урока: Исследовать, какие условия влияют на скорость химических реакций.
Задачи урока: обучающая: закрепить знания учащихся о понятии скорости
химической реакции и факторах, влияющих на
нее;
развивающая: представлять конкретное содержание и сообщать в
письменной и устной форме, планирование общих
способов работы;
воспитывающая: устанавливать рабочее отношение в группе, уметь
проявлять инициативу, обеспечить бесконфликтную
совместную работу в группе.
Форма работы на уроке: индивидуальная, групповая.
Оборудование: компьютер, интерактивная дока, учебное электронное издание «Виртуальная лаборатория».
План урока:
- Актуализация знаний.
- Работа по интерактивной доске.
- Рефлексия.
1. Актуализация знаний.
Учитель: Мы изучили тему: «Скорость химических реакций и химическое равновесие». Цель нашего урока: «Закрепить знания о скорости химических реакциях и исследовать, какие условия влияют на скорость химических реакций».
Для этого мы с вами побываем в виртуальной лаборатории и вместе с
химиком проделаем лабораторную работу. Но для начала вспомним такие понятия, как: а) что называем скоростью химической реакции; б) факторы, от которых зависит скорость химических реакций.
Фронтальная беседа: учащиеся отвечают на поставленные вопросы.
2. Выполнение практической работы (работа по интерактивной доске)
Виртуальная лаборатория раздел « Химические реакции».
Учитель: Для того чтобы приступить к выполнению лабораторной работы, мы проведем инструктаж по технике безопасности. Он включает пять вопросов Лабораторная работа № 4.1. Скорость химических реакций.
Работа включает пять опытов, соответствующим пяти факторам. Перед каждым опытом имеется инструкция по его выполнению.
Теперь приступаем непосредственно к опытам.
В выданных лабораторных листах (Приложение №1) записываем номер, название опыта, его цель, которая вытекает из названия.
В опыте № 1: Зависимость скорости от катализатора.
Цель: исследовать, что скорость химической реакции зависит от катализатора.
Один учащийся выходит к доске и проделывает опыт по виртуальной лаборатории. После просмотра опыта учащиеся записывают уравнение и делают самостоятельно выводы (Обращают внимание на график скорость реакции с катализатором и без него).
![]()
В опыте № 2: Зависимость скорости химической реакции от температуры.
Цель учащиеся записывают самостоятельно. К доске выходит следующий ученик. Проделывая опыт, ребята наблюдают, что сначала выделяется газ, а через некоторое время жидкость становиться мутной, в результате выпавшей в осадок серы. Сначала образуется тиосерная кислота, которая далее разлагается. Вывод ребята делают, основываясь на график зависимости скорости от времени.
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
В опыте № 3: Зависимость Скорости реакции от концентрации.
У доски работает следующий ученик. Соответственно определяет цель самостоятельно.
Достаточно записать одно уравнение реакции и сделать соответствующие выводы.
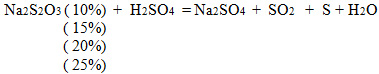
В опыте № 4: Зависимость скорости химической реакции от площади соприкосновения.
К доске выходит очередной ученик и проделывает лабораторный опыт. Учащиеся в лабораторных листах записывают название, цель, уравнения реакций и делаю выводы на основе наблюдения.
![]()
В опыте № 5 Зависимость скорости химической реакции от природы реагирующих
веществ.
У доски работает ученик, остальные самостоятельно выполняют работу и делают выводы.
Zn + 2HCl ----------- ZnCl2 + H2
Zn + 2CH3COOH --------- (CH3COO)2Zn + H2
3. Рефлексия. Учитель: Сделайте общий вывод о влиянии различных условиях на скорость химических реакций. Ответьте на вопросы:
- Какими из указанных веществ вы воспользовались для доказательства зависимости скорости реакции от концентрации веществ? (тиосульфат натрия, серная кислота).
- Как доказать. Что скорость химической реакции зависит от катализатора? Что происходит с катализатором?
- Что можно наблюдать, если вместо серной кислоты будем использовать соляную?
- Приведи свои примеры факторов, влияющих на скорость химических реакций.