Слайд №1
Пояснительная записка.
Курс "Химия" предложенный Олегом Сергеевичем Габриеляном построен на основе концентрической концепции химического образования для основной школы. Важнейшей его особенностью, является высокий теоретический уровень присущий русской школе.
Слайд №2
Учёные представители науки, занимавшиеся развитием педагогического и химического образования.
Многие ведущие педагоги и учёные внесли огромный вклад в развитие науки и образования. Педагогическая наука значительно продвинулась вперёд, открывая новые возможности в определении роли и места учителя в учебном процессе.
Слайд №3
Одним из основных и важнейших понятий в химии, является "Химическая реакция".
Знания о химической реакции представляет собой систему которая постепенно формируется у учащихся в процессе обучении химии. На основе атомно-молекулярной теории её стали рассматривать как процесс превращения молекул одних веществ в молекулы других за счёт перегруппировки атомов. Развитие знаний о строении вещества выдвинул электронную теорию строения атома. С появлением этой теории сущность химической реакции стала рассматриваться в зависимости от изменения характера химических связей между атомами в веществе. Глубокое изучение химических реакций предполагает формирование у учащихся представления о том, что внешние явления при химическом превращении закономерно связаны с внутренней его сущностью. При реакции разрывается одни химические связи и возникают новые, и как следствие этого - одни вещества превращаются в другие.
Слайд №4
Образовательная программа "Химия" О.С. Габриеляна представлена учебно-методическим комплектом.
В него входят:
- Программа курса "Химия" 8-11 класс для общеобразовательных школ
- Учебники 8-11 класс
- Рабочие тетради к учебникам
- Контрольные и проверочные работы
- Методические рекомендации для учителя
Слайд №5
Одним из основных и важнейших понятий в "Химии" является понятие о "Химической реакции" как форме движения материи. В процессе обучения формируется целостная картина мира.
Слайд №6
Целью обучения
в разделе "Химические реакции", является формирование личности,
- обладающей знаниями основ химической науки как фундамента современного естествознания;
- убеждённой в материальном единстве мира веществ и объективности химических явлений;
- понимающей необходимость сбережения природы - основу жизни на Земле.
Слайд №7
При разработке раздела "Химические реакции" были поставлены задачи.
Образовательные
- Формирование целостной картины мира.
- Формирование практических умений и навыков.
- Систематизация знаний о химических реакциях.
Развивающие
- Развитие и совершенствование умений и навыков учебной деятельности.
- Развитие способностей формулировать свои мировоззренческие позиции в процессе изучения темы.
- Развитие познавательного интереса.
- Развитие умения сравнивать, анализировать, делать выводы
Воспитательные
- Становление и развитие нравственных и мировоззренческих устоев личности.
- Воспитание трудолюбия, целеустремлённости и аккуратности
Слайд №8
Результатом обучения будет:
Будут знать
- сущность химических реакций
- классификацию химических реакций по различным признакам
- взаимосвязь химических превращений между неорганическими и органическими веществами
Будут уметь
Слайд №9
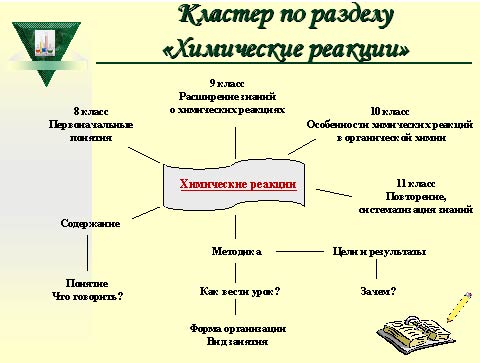
Разработка раздела "Химические реакции" представлены следующим кластером, на котором представлена последовательность работы этапов по теме "Химические реакции"
Слайд №10-11
Структура содержания тематических модулей образовательной программы представлена в виде таблиц по классам с указанием темы урока, её содержанием и деятельностью учащихся.
8 класс
| Тема | Содержание темы | Деятельность учащихся |
| Физические и химические явления. | Формирование понятия о физических и химических явлениях. | Учатся распознавать, разделять и анализировать природные явления. Работают с раздаточным материалом. Выполняют химические опыты. |
| Признаки и условия протекания химических реакций. | Закрепление знаний о признаках и условиях протекания химических реакций. | Рассматривают признаки, по которым определяют химические реакции. |
| Закон сохранения массы веществ. | Формулирование закона сохранения массы веществ при химических реакциях, показ его физической сущности. | Знакомятся с работами М.В.Ломоносова в области химии. |
| Химические уравнения. | Формулирование понятия "реагент" и "продукты реакции", правил подбора коэффициентов. | Сравнивают схему и уравнение химической реакции. Составляют уравнение химических реакций. |
| Расчёты по химическим уравнениям. | Получение информации о реакции из её уравнения. Формирование умения вычислять по уравнениям химических реакций. | Знакомятся с алгоритмом решения расчётных задач по уравнениям химических реакций. Решают задачи по уравнениям химических реакций. |
| Типы химических реакций. Реакция разложения и соединения. | Формирование знания о реакциях соединения и разложения. Знакомство с эндо и экзотермическими реакциями. | Рассматривают сущность реакций. Знакомятся с термохимическими уравнениями и особенностями их записи. |
| Типы химических реакций. Реакции замещения и обмена. | Формирование знания о реакциях замещения и обмена. | Изучают реакции по числу и составу исходных веществ и продуктов реакции. |
| Тема | Содержание темы | Деятельность учащихся |
| Систематизация и обобщение знаний. | Отработка умения составлять уравнения химических реакций и решать расчётные задачи. Рассматривание основных положений атомно-молекулярного учения и значение работ М.В.Ломоносова. | Отрабатывают и закрепляют умения различать физические и химические процессы. Подготавливаются к контрольной работе. Выполняют задания различного вида. |
| Контроль знаний, умений, навыков. | Контролирование усвоения основных понятий темы, умения решать расчётные задачи. | Выполняют работу по карточкам. |
| Ионные уравнения реакций. | Формирование понятий о реакциях ионного обмена. Объяснение отличия сокращённого ионно-молекулярного уравнения от молекулярного. | Знакомятся с алгоритмом составления ионно-молекулярного уравнения реакции. |
| Условия протекания реакций обмена до конца в свете ТЭД. | Ознакомление с реакциями, протекающими с образованием осадка, газообразного вещества, слабодиссоциирующего вещества. | Закрепляют навыки написания полных и сокращённых ионно-молекулярных уравнений реакции. |
| Окислительно-восстановительные реакции. | Понятие об окислительно-восстановительных реакциях, степени окисления, окислителях и восстановителях. | Учатся определять степень окисления. |
| Составление окислительно-восстановительных реакций. | Знакомство с методом электронного баланса. | Выполняют упражнения по составлению уравнений окислительно-восстановительных реакций методом электронного баланса. |
| Реакции ионного обмена и окисл.-восстановит. реакции. | Рассмотрение различий в окислительно-восстановительных реакциях ионного обмена. | Упражняются в составлении уравнений реакций. |
Слайд №12
9 класс
| Тема | Содержание темы | Деятельность учащихся |
| Систематическое повторение реакций ионного обмена и окислительно-восстановительных при изучении тем "Металлы" и "Неметаллы". | Рассмотрение общих свойств классов химических элементов металлов и неметаллов. | Повторяют, обобщают и развивают полученные в 8 классе основные понятия, законы и теории базового курса. |
Слайд №13
10 класс
| Тема | Содержание темы | Деятельность учащихся |
| Особенности изучения химических реакций в органической химии. | Формирование понятия особенностей реакций для органических веществ. Ознакомление с классификацией органических реакций по характеру превращения. | Анализируют различия в разной скорости протекания реакций в неорганической и органической химии, необходимость катализатора для химических реакций органических веществ. |
| Реакции замещения. |
Формулирование определения "реакции замещения", как реакции, в результате которой происходит замена одного атома или группы атомов в исходной молекуле на другие атомы. | Выясняют особенности реакции замещения, сравнивают с рассмотренными реакции замещения в неорганической химии (между простыми и сложными). |
| Реакции присоединения. |
Формулирование понятия реакций присоединения, в которые вступают ненасыщенные соединения, их отличие от реакций присоединения в неорганической химии. | Различают реакции
присоединения:
|
| Реакции отщепления. | Определение реакций отщепления или элиминирование. | Знакомятся с отличием для реакции отщепления. Сопоставляют, что реакции отщепления являются процессами обратными реакциям присоединения. |
| Способы образования и разрыва ковалентной связи. Типы реакционноспособных частиц в органической химии. | Ознакомление учащихся с типами реакционноспособных частиц в органической химии. | Вспоминают, что для органических соединений наиболее распространённая химическая связь - это ковалентная. |
Слайд №14
11 класс
| Тема | Содержание темы | Деятельность учащихся |
| Реакции, идущие без изменения состава вещества. | Рассмотрение сущности реакций, идущих без изменения состава. | Обобщают понятия аллотропия и аллотропные видоизменения О2, О3, С, Р |
| Реакции, идущие с изменением состава вещества. | Повторение реакций замещения, соединения, разложения, обмена в органической и неорганической химии. | Рассматривают классификацию химических реакций на конкретных примерах. |
| Энергетика химических реакций. | Формирование представления учащихся о тепловом эффекте реакции. | Учатся производить расчёты по термохимическим уравнениям. |
| Скорость химических реакций. | Определение понятия "скорость химической реакции". Рассмотрение зависимости скорости от различных факторов. | Углубляют знания о факторах, влияющих на скорость реакции. Формируют умение решать задачи на химическую кинетику. |
| Обратимость химических реакций. | Актуализирование и расширение знаний учащихся о химическом равновесии и его смещении. | Углубляют знания о необратимых и обратимых реакциях. Знакомятся с понятием химического равновесия и его смещением. |
| Гидролиз органических и неорганических соединений. | Определение понятия о реакции веществ с водой. Гидратация в органической химии. | Знакомятся с обратимым и необратимым гидролизом, его практическим значением для получения спирта и мыла. |
| Окислительно-восстановительные реакции. | Закрепление понятия "степень окисления", "окислительно-восстановительные реакции". | Закрепляют умение определять степени окисления по формуле соединения. Различают процессы окисления и восстановления. |
Слайд №15
Принципы отбора содержания
- Преемственность
- Последовательность
- Связь обучения с практикой
- Соответствие содержания требованиям современного образования
- Единство содержания и методики преподавания
- Учёт возрастных особенностей учащихся
Слайд №16
При проведении уроков использую следующие
технологии и формы организации деятельности
- ИКТ (информационно коммуникативные технологии)
- Здоровьесберегающие технологии
- Коммуникативные технология
Классно-урочная система
- Урок (комбинированный, сообщения новых знаний, формирования и закрепления умений и навыков, обобщающий, контрольный )
- домашняя работа
- внеклассная работа
- внеурочная работа
- экскурсии
- факультативы
Лекционно-семинарская система
- лекция - практику
- семинар - экзамены
- зачёт - собеседование
- консультация
Слайд №17-35:
Методы и приёмы изучения
- Соблюдение правил техники безопасности
- Учёт закона сохранения масс веществ при расчётах
- Анализ и распределение природных явлений
- Проведение тематических диктантов
- Использование наглядных таблиц
- Составление схем химических реакций
- Работа со схемами реакций
- Проведение тематических викторин
- Систематизация знаний
- Вопросы с деформированным ответом
- Проведение лабораторных опытов
- Закрепление знаний химических свойств
- Выполнение практических заданий
- Проведение самостоятельных работ
- Возможность применения теоретических знаний на практике
- Использование видеофильмов и презентаций
- Демонстрация опытов
- Использование знаний при решении экологических проблем
Слайд 36-38:
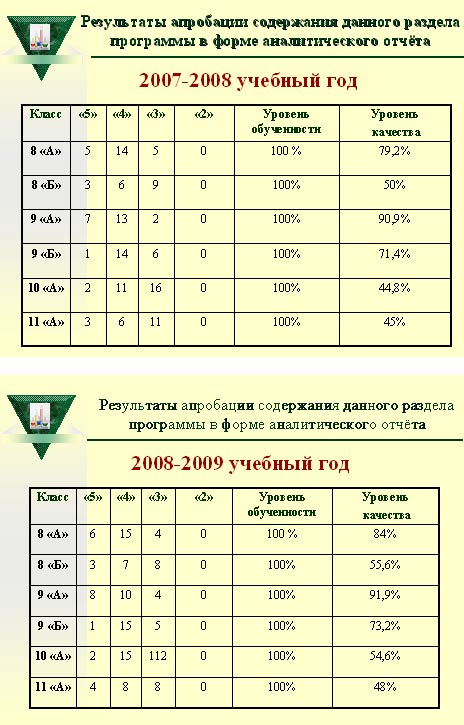
Результаты апробации содержания данного раздела программы представлены по каждому классу в форме аналитического отчёта по годам

Слайд 39:
Вывод:
Система работы по данному разделу - целенаправленный процесс, в результате которого учащиеся убеждаются в том, что "химическая реакция" является одной из важных форм движения материи, через которую происходят познания целостности картины мира.
Слайд №40:
Список использованной литературы для учителя.
1) Аверкиева Г.И. Загадки реакций обмена. -М: Химия в школе, 1982 г №2 стр.57
2) Брейгер Л.Н. Химия 11-й класс поурочные планы. -Волгоград: Учитель, 1997 г
3) Габриелян О. С. Химия 8-9/ методическое пособие. -М: Дрофа, 2001 г.
4) Габриелян О. С., Рунов Н. Н. Химический эксперимент в школе. -М: Дрофа, 2000 г.
5) Городова Н.М. Сборник тестовых заданий по химии для 8-9 классов. -М: Наука, 1998 г
6) Денисова В.Г. Мастер- класс учителя химии 8-11 класс. -М: Глобус, 2010 г
7) Кирюшин Д.М. Методы обучения в средней школе. -М: Просвещение, 1991 г.
8) Крицман В.А. Д.И. Менделеев о химических реакциях. -М: Химия в школе, 1984 г №3 С.16
9) Маршанова Г.Л. Сборник задач по органической химии. -М: Издат-школа, 2005 г.
10) Маршанова Г.Л. 500 задач по химии 8-11 классы. -М: Издат-школа, 2000 г
11) Пасечник Б.Н. Развитие самостоятельности и творческих способностей учащихся при изучении химии. -М: Химия в школе 1986 №1 С.55
12) Плетнер Ю.В., Полосин В.С. Практикум по методике обучения химии. -М: Просвещение, 1998 г.
13) Радецкий А.М., Курьянова Т.Н. Дидактический материал по общей химии для 11 класса./ Пособие для учителя. -М: Просвещение, 2001 г
14) Савич Г.З. Формирование понятий о химической реакции. -М: Просвещение, 1991 г.
15) Чертков И.Н. Обучение химии в 10-м классе ( в двух частях). -М: Просвещение, 1992 г
16) Эмануэль Н.М. Химическая кинетика. -М: Знание, 1991 г.
Слайд №41:
Источники информации для учащихся.
1) Авербух А.Я., Богушевская К.К. Из чего, как и что получается. -Л: Лениздат, 1967 г.
2) Бальян В. Чудесные превращения". -Л: Лениздат, 1979 г.
3) Галичкина О.В. Занимательня химия на уроках 8-11 классов. -Волгоград: Учитель, 2007 г
4) Гладков К.А. Атом от А до Я. -М: Атомиздат, 1966 г
5) Егоркин В.Ф., Кирюшин Д.М., Полосин В.С. Внеклассные занятия по химии. -М: Просвещение, 1965 г.
6) Лукашёв К.И. Атомы и наша планета. -М: Знание, 1995 г.
7) Марголис Л.Я. Волшебная палочка химии. -М: Наука, 1998 г.
8) Минченко Е.Е. Зазнобина Л. С. Химия 8
9) Николаев Л.А. Катализ и катализаторы. -М: Учпедгиз, 1961 г.
10) Паринин В.П., Казакова З.С. Палитра химии -М: Наука, 1985 г.
11) Перельман А.И. Атомы в природе. -М: Наука, 1997 г.
12) Регель Дж. Энергия, Жизнь и Организм, -М: Мир, 1985 г.
13) Розен Б.Я. Тайны невидимого мира. -М: Знание, 1996 г.
14) Шпаусус З. Путешествие в мир химии. -М: Просвещение, 1985 г.
15) Энциклопедия для детей Химия. -М: Аванта, 2000 г.