Цели урока:
- закрепить знания учащихся о составе изученных веществ, классификацию неорганических соединений, виды химических связей и типы кристаллических решеток;
- совершенствовать умения устанавливать принадлежность веществ к определенному классу веществ, составлять формулы оксидов, и соответствующих им кислот и оснований;
- продолжить формирование навыков по распознаванию веществ.
Оборудование: компьютер, интерактивная доска, проектор, раздаточный материал (таблицы «Типы кристаллических решеток», «Виды химической связи»), лабораторное оборудование.
ХОД УРОКА
I. Организационный момент
Учитель сообщает учащимся цель урока, правила работы в группах, с листом заданий и с оценочным листом.
II. Основная часть
1. Состав основных классов неорганических соединений
Учитель. На первом этапе урока мы с
вами повторим классификацию, состав и
генетическую связь основных классов
неорганических соединений.
Обратитесь к «Листу заданий» (Приложение
1) и выполните упражнения, соблюдая
критерии оценки. (После выполнения
учащимися задания, проверяется правильность
выполнения его. Если задание выполнено
письменно, то учащиеся, оценивая свою работу,
ставят отметку в «Оценочный лист» (Приложение
2) в графу «Самооценка», а после
обсуждения в группе – в графу «Оценка группы».
Когда группа готова сообщить о результатах
выполнения задания, представитель группы
поднимает руку и отвечает. Другие группы могут
дополнять, исправлять, уточнять ответ.
Правильные ответы проецируются в виде слайдов на
экран).
Задание 1. Актуализация знаний
Закончите предложения в листе рассказа и перескажите их.
Лист рассказа.
«Классификация неорганических соединений».
- По составу все вещества делятся на две большие группы … и …
- Приведите примеры простых и сложных веществ.
- Простые вещества делятся на … и …
- Приведите примеры металлов и неметаллов.
- Среди сложных веществ можно выделить 4 класса:
а)… б) … в) … г) …
После обсуждения в группах, один из учащихся отвечает, остальные группы слушают. Если есть необходимость, исправляют и дополняют.
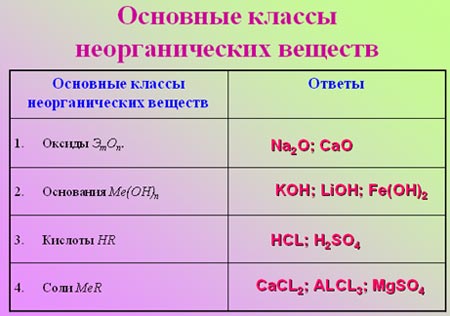
Задание 2. Классификация неорганических веществ.
Заполните таблицу, распределив вещества по основным классам. (Правильные ответы демонстрируются на слайде после выполнения задания).
1. Na2O 2. KOH 3. CaCl2 4. LiOH 5. Fe(OH)2 6. AlCl3 7. CaO 8. HCl 9. H2SO4 10. MgSO4
Для самооценки и групповой оценки используйте критерий: 10 формул – «5», 7-9 – «4», 5-6 – «3».
Учитель: Какие вещества называются оксидами?
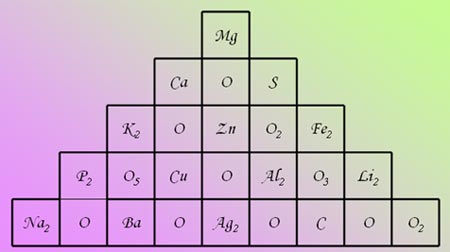
Задание 3. Оксиды и их классификация
Составьте химические формулы возможных
оксидов, комбинируя приведенные в таблице части
формул слева направо и сверху вниз. Общее число
формул равно значению относительной
молекулярной массы углерода
Для самооценки групповой оценки использовать
критерий: 12 формул – «5», 9-11 – «4», 7-8 – «3».
Задания 4 и 5. Оксиды и соответствующие им гидроксиды (игра «Крестики – нолики»). Оценка выставляется по итогам выполнения обоих заданий.
Задание 4.
Найдите выигрышный вариант и составьте формулы гидроксидов, соответствующих приведённым формулам оксидов. (Правильные ответы демонстрируются на слайде после выполнения задания).
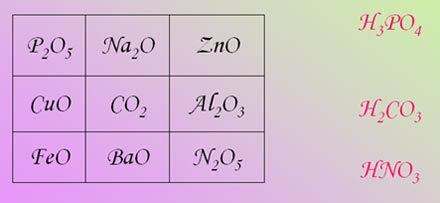
Учитель:
– Какие оксиды называются кислотными?
– Что такое кислоты?
– Что такое основность?
Задание 5.
Найдите выигрышный вариант и составьте
формулы гидроксидов, соответствующих
приведённым формулам оксидов. (Правильные
ответы демонстрируются на слайде после
выполнения задания).
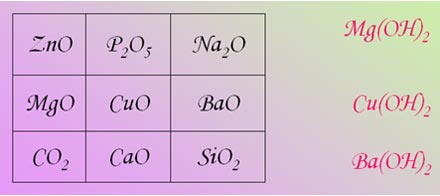
Для самооценки и групповой оценки задания 4 и задания 5 используйте критерий: 6 формул – «5»; 5 – «4», 3-4 – «3».
Учитель:
– Какие оксиды называются основными?
– Какие вещества называются основаниями?
– Что такое щелочь?
Задание 6. Генетическая связь основных классов неорганических соединний
Составьте ряд генетически взаимосвязанных веществ.
1. BaSO4, 2. CaO, 3. H2CO3, 4. BaO, 5. Ba, 6. HCl, 7. Na2O 8. Ba(OH)2
Учитель:
– К какому классу соединений относится
последнее вещество?
– Какие вещества называются солями?
Учитель: Какой вывод мы можем сделать по первому этапу уроку?
Примерный ответ учащихся: На первом этапе урока мы рассмотрели состав основных классов неорганических соединений.
2. Металлы и неметаллы. Химическая связь
Учитель. На втором этапе урока нам предстоит вспомнить строение атомов металлов и неметаллов. Типы химической связи и кристаллических решеток. А также выяснить, чем обусловлены свойства веществ.
Задание 7. Строение атомов химических элементов металлов и неметаллов.
Укажите буквами характеристики, соответствующие металлам (1 ученик) и неметаллам (2 ученик). Проверьте результаты работы друг у друга. (Правильные ответы демонстрируются на слайде после выполнения задания).
Характеристики:
А) Высшая степень окисления равна: от +1 до +3.
Б) Простые вещества преимущественно
твёрдые, обладают металлическим блеском, ковкие,
хорошие проводники тепла и электричества.
В) Простые вещества могут быть твёрдыми, жидкими
и газообразными, металлическим
блеском практически не обладают,
хрупкие, изоляторы.
Г) Высшая степень окисления равна от +4 до +7.
Д) Оксиды и гидроксиды проявляют основные
свойства.
Е) Образуют летучие водородные соединения.
Ж) Оксиды и гидроксиды проявляют кислотные
свойства.
З) Летучих водородных соединений не образуют.

Для самооценки и групповой оценки используйте критерий:4 правильных ответа – «5», 3 – «4», 2 – «3».
Задание 8. Виды химической связи и тиы кристаллических решеток.
Определите тип химической связи и тип кристаллической решётки, которые характерны для приведённых в таблице веществ.
Вещества |
Тип химической связи | Тип кристаллической решётки |
| 1. Водород (H2 ) 2. Хлорид натрия (NaCl) 3. Алмаз (С) |
Учитель: Какой вывод мы можем сделать по второму этапу уроку?
Примерный ответ учащихся: Свойства веществ зависят от строения кристаллов.
3. Лабораторный опыт
Задание 9.
Учитель: У вас на столах находится лабораторное оборудование. Прочтите инструктаж по технике безопасности при работе с кислотами и щелочами. Определите, какое вещество находится в пробирке.
Индикатор |
Изменение окраски индикатора | Вывод |
|
Учитель: Какие вещества называются индикаторами? Какие реакции называются качественными?
III. Рефлексия
- Индикатор.
- Растворимое в воде основание.
- Элемент III группы, 5 периода.
- Основная отрасль использования кислорода.
- Драгоценный металл.
- Гидроксид, соответствующий оксидам неметаллов.
- Отрицательно заряженная частица, входящая в состав атома.
- Элемент VI группы, 4 периода.
- Месяц, в котором был открыт периодический закон.
V. Подведение итогов урока