Цели урока:
Обучающая – изучение и закрепление нового материала по данной теме, а также обучение навыкам самостоятельной работы с конспектом, справочной литературой, компьютерным текстом и тестами, применение теоретических знаний к решению задач и объяснению результатов проведенных опытов;
Развивающая – развитие умений анализировать и делать выводы, устанавливать причины полученных результатов, развитие навыков самостоятельной и коллективной работы;
Воспитательная – привитие интереса к изучаемому предмету, к самоорганизации и культуре труда, а также чувства бережного отношения к природным ресурсам и охраны окружающей среды.
Наглядные пособия: таблицы “Периодическая система Д.И.Менделеева”, “Электрохимический ряд напряжений металлов”, “Растворимость соединений”, карточки-задания с уравнениями реакций, с цепочками превращений, методическое пособие “Окислительно-восстановительные реакции”, учебники;
Компьютерное обучение: компакт-диск “Общая и неорганическая химия” (раздел “Характеристика d-элементов”).
Ход занятия
I. Организационный момент.
Приветствие, отметка в журнале отсутствующих, ознакомление с темой и планом работы на данном занятии.
II. Повторение.
Преподаватель напоминает, что мы продолжаем изучать свойства d-элементов. Какие d-элементов (переходные) мы уже прошли? (правильно, это элементы I-ой группы – серебро, медь, II-ой группы – цинк, ртуть, элемент VI-ой группы - хром). Что же характерно для всех этих переходных элементов? (Правильно, образование комплексных соединений, часто сами вещества и их растворы бывают окрашены, а также что все d-элементы- металлы) [2]. Вспомним электронные конфигурации d-элементов. Какой или какие слои заполняются электронными (правильно, предвнеший d-слой и внешний s-слой). Напоминаю, что именно из-за наличия d-оболочки свойства этих элементов отличаются от свойств элементов основных групп. Поэтому их выделили в так называемые побочные подгруппы.
III. Объяснение нового материала.
(По ходу объяснения материала учащиеся ведут записи в своих тетрадях, т.е. составляют конспект лекций – подготовка к традиционному вузовскому обучению. Кроме этого, постоянно идет диалог учитель-ученик для лучшего понимания и усвоения нового материала).
Итак, давайте вместе составим электронную конфигурацию валентных электронов для марганца. (на доске учитель с подсказками детей записывает электронную формулу для марганца: 3 d5 4 s2 ,т.е. всего 7 валентных электронов, а марганец расположен поэтому именно в VII-ой группе < Приложение1> (марганец). Характерные степени окисления данного элемента обусловлены отдачей нескольких или полностью всех валентных электронов: Mn+2, Mn+4, Mn+6 и Mn+7). Подчеркиваю, что в своих соединения марганец чаще всего может проявлять именно такие степени окисления [5].
Далее для приобретения навыков самостоятельного поиска необходимой информации по книгам, справочникам, Интернету учитель заранее попросил некоторых учащихся подготовить несколько интересных сообщений по заданной теме (учащиеся вызываются к доске и рассказывают свое сообщение, причем одновременно остальные ученики конспектируют излагаемый материал. По ходу такого объяснения к докладчикам задаются вопросы, а также учитель своими наводящими вопросами просит более подробно объяснить смысл излагаемого материала для лучшего понимания как самим докладчиком, так и остальными учащимися).
Например, учитель говорит: “А теперь, давайте рассмотрим историю открытия данного элемента”. Выходит 1-й докладчик по данной теме < Приложение1> (история открытия марганца). 2-й докладчик выступает по теме “Нахождение марганца в природе”, 3-й – “Получение”.
После работы с сообщениями учитель дает лекционный материл по разделу “Химические свойства марганца” < Приложение1> (Физические и химические свойства).
Заканчивается прохождение новой темы выступлением учащегося по применению марганца и его биологической роли < Приложение1> (Применение, биологическая роль).
IV. Закрепление пройденного материала.
Для этого учитель делит учеников на три рабочие группы: “Теоретики”, “Экспериментаторы” и “Промышленники” (каждый ученик заранее подготовил себе персональный бейджик с названием своей группы и своим именем с целью формирования у учащихся чувства ответственности за порученное дело и полученный результат, уважения к себе и своим сверстникам, а также для поднятия уровня собственной самооценки).
Каждая группа получает некоторое задание, в ходе выполнения которого идет активная проработка нового и закрепление пройденного раннее материала, поиск нестандартных решений, формируются чувства коллективизма, навыки самостоятельной работы.
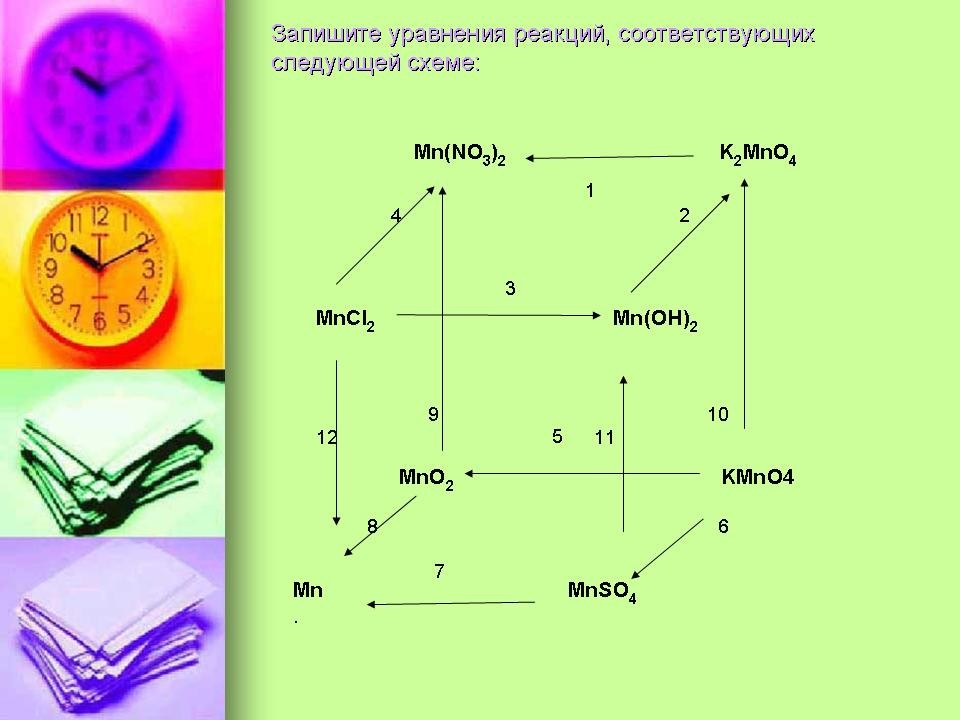
Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое коричневое пятно. Попробуйте восстановить уравнения.
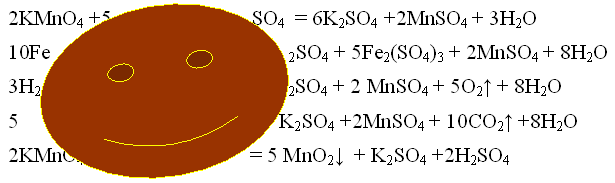
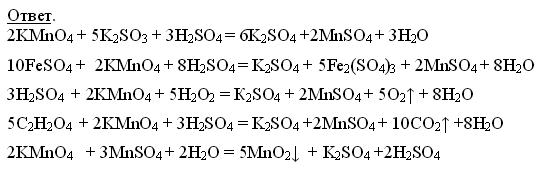
Задание группе –экспериментаторов [4]. Даны следующие вещества: KI, H2SO4, KMnO4, NaOH, FeSO4 ·7H2O, H2O2, H2O.
1.Назовите указанные вещества.
2.Выберите те из них, которые относятся к :
а) окислителям;
б) восстановителям.
3. Вспомните влияние среды на характер протекания ОВР и напишите уравнения полуреакций в ионном виде для следующих веществ:
Превращения KMnO4 в:
а) кислой среде;
б) щелочной среде;
в) нейтральной среде;
Превращения Н2О2 в:
а) кислой среде;
б) щелочной среде.
4. Напишите все возможные ОВР между указанными вначале веществами в молекулярной форме. Уравняйте их методом электронно-ионного баланса. Укажите на количественный критерий возможности протекания данных ОВР (использование справочника).