В условиях современной школы возрастает учебная нагрузка и сокращается двигательная активность учащихся. На своих уроках стараюсь реализовать здоровьесберегающий подход посредством рациональной организации учебного процесса: оснащения необходимым учебным оборудованием, организацией рабочих мест учащихся, использованием комплекса методов и средств обучения, отвечающих возрастным и индивидуальным особенностям детей. Мною разработана система уроков с элементами здоровьесберегающих технологий. Я предлагаю один из уроков по теме «Кислород. Оксиды. Горение». На этом уроке используется:
- учебный материал, направленный на формирование ЗОЖ.
- средства обучения - кислородная подушка для демонстрации опытов с кислородом, оборудования для проведения экологически безопасного эксперимента – для сгорания веществ в кислороде используется замкнутый сосуд. Колба герметично закрывается пробкой, вставленной в нее ложечкой для сжигания веществ.
- элемент организационно-двигательной активности учащихся посредством физических упражнений на дыхание, мышцы шеи и плечевого пояса. Затрагиваются вопросы охраны окружающей среды и здоровья человека.
Новый материал объясняется по учебнику В.В.Еремина и Н.Е.Кузьменко, используется мультимедийное учебное пособие и учебник Г.Е.Рудзитис.
Тема урока: «Свойства кислорода и его применение»
Цель урока:
- Образовательные: обобщение, углубление и систематизация знаний по теме «Кислород. Оксиды. Горение». Активизировать знания учащихся о процессах горения и медленного окисления.
- Развивающие: развитие мышления учащихся, в том числе умения анализировать, активизировать познавательный интерес с помощью химического эксперимента. Развивать эмоциональную сферу учащихся, используя стихи.
- Воспитательные: воспитание потребности в знаниях, целеустремленность, наблюдательность, умение работать в коллективе. Экологическое воспитание - напомнить о значении кислорода для жизни на Земле, необходимости его сбережения, охраны окружающей среды.
На экране эпиграф: «Кислород - это вещество, вокруг которого вращается земная химия». (Я. Берцелиус).
Оборудование: Компьютер, экран, электронный учебник, кислородная подушка, колбы, спиртовка, металлические ложки.
Реактивы: Сера, фосфор, уголь, железная струна.
Таблицы:
- Химический знак- O
Относительная атомная масса - Ar= 16
Химическая формула- O2
Относительная молекулярная масса - Mr = 32
Валентность - II - Получение кислорода:
2HgO = 2Hg + O2
2KMnO4= K2MnO4 + MnO2 + O2
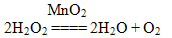
2KClO3 = 2KCl + 3O2
Ход урока
1. Организационная часть
Учитель: Добрый день, ребята! Я хочу прочитать вам стихотворение, а вы угадайте о каком газе идет речь?
Примерно века два назад открыт он был случайно.
Сейчас знаком с ним стар и млад и он для нас не тайна.
Без газа этого на свете не жили б звери и народ.
Его узнать могли бы дети, ведь это - … (кислород).
Правильно - кислород! И мы продолжаем путешествие по теме «Кислород».
Давайте улыбнемся друг другу и настроимся на поиск и творчество.
Сегодня перед нами стоит задача: выяснить, какими свойствами обладает это удивительное вещество?
2. Повторение: (фронтальная беседа с классом).
Учитель:
- Что является источником кислорода на нашей планете? (Зеленые растения.)
- Зеленые растения нам дают кислород и мы дышим этим кислородом. А в лаборатории из каких веществ мы можем получить кислород? (Ученики называют вещества, а кто не помнит, смотрит на таблицу «Получение кислорода». Ученики делают вывод, что разложением кислородосодержащих веществ можно получить кислород).
- Перечислите методы собирания кислорода в лаборатории. (Ответ: методом вытеснения воздуха и методом вытеснения воды).
На прошлом уроке мы с вами получили кислород из перманганата калия методом вытеснения воздуха. Сейчас посмотрим фрагмент фильма получение кислорода методом вытеснения воды. А вы, подумайте, почему это возможно? (Фрагмент фильма мультимедийного учебного пособия).
Ученик: Потому что кислород плохо растворяется в воде.
3. Новая тема:
Учитель: Правильно, это одно из свойств кислорода. Мы с вами переходим к изучению новой темы «Свойства кислорода и его применение» (ученики записывают тему урока).
Учитель: Нам не нужно собирать много кислорода, у нас есть кислородная подушка. Что вы можете сказать о кислородной подушке?
Ученик: Подушка заполнена кислородом, используется в больницах для поддержания дыхания больных.
Физические свойства: (ученики записывают в тетрадь).
Опыт: Учитель набирает кислород в колбу из подушки.
Учитель: Какого цвета кислород?
Ученик: Кислород без цвета.
Учитель: Есть ли запах? Без запаха. Плохо растворяется в воде. Немного тяжелее воздуха. При температуре -183° кислород сжижается в голубую жидкость, а при снижении -218° затвердевает.
Как можно обнаружить кислород? (Тлеющая лучинка вспыхивает). Кислород поддерживает горение.
Учитель: Посмотрим, как горят в кислороде сера, фосфор, углерод, железо и сравним, как они горят на воздухе.
Химические свойства кислорода: (ученики записывают в тетрадь).
Учитель:
1. При нагревании кислород взаимодействует со многими веществами (проводит опыт с углем). Если опустить в сосуд с кислородом тлеющий уголек, то он раскаляется добела и сгорает. При горении угля образуется диоксид углерода (уравнение реакции может ученик написать у доски).
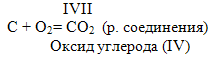
Лавуазье доказал, что углекислый газ – это соединение кислорода с углеродом. Он на опыте показал, что при дыхании поглощается кислород и образуется углекислый газ, т.е. процесс дыхания подобен процессу горения угля. По результатам этого опыта, какой вывод мы можем сделать?
Ученик: Мы увидели свет, значит, произошла химическая реакция. Так же убедились в том, что кислород поддерживает горение.
2. Горение серы в кислороде (учитель проводит опыт). Сера горит в кислороде ярким синим пламенем с образованием газообразного диоксида серы (ученик пишет у доски уравнение):
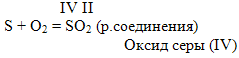
3. Горение фосфора в кислороде (учитель проводит опыт). Ярким пламенем сгорает в кислороде и фосфор. При этом образуется белый дым, состоящий из твердых частиц оксида фосфора (V) (у доски ученик пишет уравнение).
![]()
4. В кислороде горят и такие вещества, которые считаются негорючими, например - железо. Если к тонкой железной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо (проводит опыт). Горение железа происходит с треском и разбрызгиванием ярких искр- капелек расплавленного оксида железа (ученик пишет уравнение у доски).
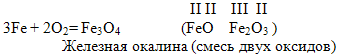
Учитель: Какие вещества мы получили: простые или сложные? Из скольких элементов они состоят?
Ученик: Получили сложные вещества в каждом случае один из элементов - кислород.
Учитель: Какие вещества называются оксидами?
Ученик: Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород (ученики записывают определение).
Учитель: Какие бывают оксиды?
На экране схема образования оксидов:
Металл + кислород = оксид металла
Неметалл + кислород = оксид неметалла
Вывод: Оксиды металлов и оксиды неметаллов.
Учитель: Взаимодействие веществ с кислородом относится к реакциям окисления. В этих реакциях обычно образуются оксиды. Окисление бывает медленное - ржавление железа (фрагмент фильма из электронного учебника) и быстрое (горение). Горение - это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света (ученики записывают в тетрадь). Оксиды известны почти для всех химических элементов, кроме легких благородных газов (гелия, неона, аргона показывает по таблице Менделеева). Некоторые химические элементы, например золото и платина, хотя и образуют оксиды, но непосредственно с кислородом не соединяются. Такие оксиды получают косвенным путем - из других соединений. В кислороде горят и некоторые сложные вещества, при этом так же образуются оксиды. Так, продуктами горения метана и ацетилена являются углекислый газ и вода.
CH4 + 2O2 = CO2 + 2H2O
Сероводород H2S газ с запахом тухлых яиц - сгорает в кислороде с образованием сернистого газа и воды:
2H2S + 3O2 = 2SO2 + 2H2O
Учитель: Какой вывод можем сделать?
Ученик:
- Реакция горения - это реакция окисления (учитель дополняет: дыхание тоже относится к реакциям окисления).
- Кислород при нагревании реагирует с другими веществами с образованием оксидов.
4. Физкультминутка (упражнения на дыхание, на мышцы шеи, плечевого пояса, плечевые, локтевые суставы, кисти рук).
Учитель: Заканчиваем мы свое путешествие со станции: «Применение кислорода в жизнедеятельности человека».
5. Работа с учебником.
Учитель: Открываем учебники на страницу 77, по рисунку 41 составляем рассказ о применении кислорода.
Выступление ученика: Много кислорода расходуется на разнообразную деятельность человека, тратится на процессы дыхания человека, животных и растений, а так же на процессы гниения. Человек при дыхании в течение 1 минуты в среднем употребляет 0,5 дм3 кислорода, в течение суток - 720 дм3, а в год - 262,8 м3 кислорода. Можно рассчитать, что все жители земного шара (6 миллиардов) в течение года для дыхания используют 1576,8 миллиардов м3 кислорода.
Если такой объем кислорода при нормальном давлении поместить в железнодорожные цистерны, то поезд был бы протяженностью более 300 млн км, что равняется расстоянию до Солнца и обратно.
Учитель: Что будет, если исчезнет кислород?
(Ученики выходят к доске и читают стихотворение).
Ученик 1.
Все было хорошо - и вот
Вдруг исчезнет кислород
Погасли топки у котлов
Вам даже спичку не зажечь
И пироги нельзя испечь
И не сварить простой обед
А ведь еще немало бед
Его пропажа натворит
Ученик 2.
Без кислорода не горят
Ни керосин и ни дрова
Железо выплавить и сталь
Без кислорода не мечтай
И не рассчитывай извлечь
Из руд цинк, олово и медь
Ученик 3.
Без кислорода жить нельзя
Вы это знаете друзья.
И, если он исчезнет вдруг,
Погибнет все за пять минут.
А вы задумались откуда
Есть в воздухе такое чудо?
Ведь кислород нам без сомненья,
Дают зеленые растения.
Ученик 4.
И, если будем мы безумно
Вести хозяйство неразумно,
Губить зеленый плащ планеты,
Придет расплата непременно
Погибнет жизнь, исчезнут люди,
Земля пустыней мертвой будет!
Учитель: Что нужно делать, чтобы земля не была пустыней мертвой?
Ученик: Нужно беречь природу, сажать больше деревьев, не засорять леса и парки. В походах, на шашлыках с родителями за собой нужно убирать, не оставлять в лесу пластиковые бутылки, железные банки.
6. Домашнее задание на доске: Параграфы:15,17,21. Упражнения: 4,5,6стр.60
7. Закрепление: На основе закона сохранения массы веществ расставить коэффициенты в данных уравнениях и указать тип реакций (ученики по очереди выходят к доске, выполняют задание):
- Al + O2 = Al2O3
- Fe(OH)3 = Fe2O3+ H2O
- SO3+ H2O = H2SO4
- CuO + HCl = CuCl2+ H2O
- Fe3O4+ H2 = Fe + H2O
- P2O5 + H2O= H3PO4
- Fe2O3+ Al = Fe + Al2O3
- Au2O3 = Au + O2
- Na + H2O= NaOH + H2
- Ca + O2 = CaO
Занимательные вопросы (если на уроке осталось время).
1 вопрос. Почему горение веществ на воздухе происходит медленнее, чем в кислороде?
Ответ: Кроме кислорода, который составляет 1/5 часть воздуха, в состав воздуха входят другие компоненты, которые не поддерживают горение. Поэтому горение на воздухе происходит медленнее.
2 вопрос. Почему перед уходом со стоянки туристы засыпают землей угли костра?
Ответ: Так перекрывают доступ кислорода к углям, чтобы костер не смог снова загореться и не возник пожар.
3 вопрос. Сорные куры строят гнезда из мусора и гниющих остатков растений. В них на определенной глубине они откладывают яйца. Самец время от времени помещают клюв в кучку мусора и частично раскидывают ее сверху или, наоборот, делают выше. Для чего он это делает?
Ответ: В гнезде происходит медленное окисление с постепенным выделением теплоты. Клюв птицы играет роль термометра, измеряя температуру в гнезде. Если там становится жарко, самец раскидывает кучу мусора. И наоборот, нагревает ее, если в гнезде прохладно.
4 вопрос. Влажное зерно нельзя хранить в больших кучах, поскольку может произойти обугливание и даже самовозгорание. Объясните, почему это происходит.
Ответ: В данном случае мы сталкиваемся с медленным окислением. Зерно медленно реагирует с кислородом, и теплота выделяется постепенно. Когда зерно лежит в больших кучах, то теплота выделяется в количестве, достаточном для обугливания или даже самовозгорания. Чтобы этого не происходило, зерно перелопачивают, т.е. перебрасывают с места на место.