Цель урока: установить зависимость между двумя термодинамическими параметрами при неизменном третьем
Ход урока
I. Объяснение нового материала.
Лекция: Исследование термодинамических процессов мы начнём с изучения более простой системы - газа. Для него экспериментально были установлены простые законы, связывающие термодинамические параметры.
Изменение одного из макроскопических параметров вещества определённой массы, давления Р, объёма V или температуры Т вызывает изменение остальных параметров.
Если одновременно меняются все величины, характеризующие состояние газа, то на опыте достаточно трудно установить какие-либо определённые закономерности. Проще сначала изучить процессы, в которых масса и один из параметров Р, V или Т остаются неизменными.
Количественные закономерности между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
1. Закон Бойля-Мариотта.
Этот закон был открыт английским учёным Р. Бойлем в 1660г. Работа Бойля называлась "Новые эксперименты касающиеся воздушной пружины".
Бойль изучал изменение давления газа в зависимости от объёма при постоянной температуре.
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Рассмотрим два состояния термодинамической системы:
Р1, V1, Т - начальное состояние
Р2, V2, Т - конечное состояние
Для этих состояний записываем уравнение Клапейрона-Менделеева
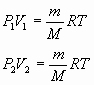
Независимо от Бойля несколько позднее к тем же выводам пришёл французский учёный Э. Мариотт. Поэтому этот закон получил название Бойля-Мариотта.
Для данной массы идеального газа произведение давления на его объём при неизменной температуре есть величина постоянная.
Данный процесс изменения давления газа в зависимости от объёма изображается графически с помощью кривой, которая называется изотермой.
Чем выше температура, при которой происходит процесс, тем выше расположена изотерма.
В системах координат Р, Т и V, Т изотермический процесс изображается прямой, параллельной соответственно оси Р или V. Эти прямые тоже изотермы. Третий параметр не сохраняет вдоль них постоянного значения.
2. Закон Гей-Люссака.
Рассмотрим процесс, при котором неизменным остаётся давление.
Процесс изменения состояния данной массы идеального газа при неизменном давлении называется изобарным.
Рассмотрим два состояния термодинамической системы:
Р1, V1, Т1 начальное состояние, где Т1=273К
Р2, V2, Т2 конечное состояние,
где ![]() T2=t+T1, T2=t+273
T2=t+T1, T2=t+273
Запишем уравнение Клайперона-Менделеева, объединив все величины, которые остаются неизменными:
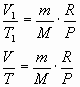
обозначим ![]() -
температурный коэффициент объемного расширения
-
температурный коэффициент объемного расширения
![]()
Эту зависимость установил опытным путём в 1802г французский физик Гей-Люссак.
Для данной массы идеального газа при неизменном давлении объём зависит от температуры по линейному закону.
Демонстрация: довольно просто закон Гей-Люссака можно продемонстрировать с помощью колбы с изогнутой трубкой. В горизонтальной части трубки имеется капелька жидкости, отделяющая газ в колбе от атмосферного воздуха. Если подогревать колбу (даже руками), то капелька жидкости сместится вправо, т. е. объём газа, находящегося в колбе увеличится, а давление остаётся равным атмосферному.
Графически изобарный процесс с помощью координатных осей V, T изображается прямой, продолжение которой проходит через начало координат-изобарой.
Угол ее наклона к оси температур зависит от давления: чем больше давление, тем меньше угол наклона.
На диаграммах с координатными осями P T и P V изобары имеют вид прямых, параллельных оси T или соответственно оси V.
3. Закон Шарля (Объяснение ведется совместно учителем и учениками по аналогии с ранее данным материалом)
Процесс изменения состояния данной массы идеального газа при неизменном объеме называется изохорным процессом.
Рассмотрим два состояния термодинамической системы:
P1, V, T1 начальное состояние, где T1=273
P, V, T конечное состояние, где ![]()
Запишем уравнение Клапейрона, Менделеева, объединив все величины, которые остаются неизменными:
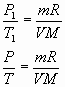
Помещая колбу с исследуемым газом в тающий лед и в пары кипящей воды, Шарль определял давление(при неизменном объеме) и вычислял температурные коэффициенты давления различных газов. Он выяснил, что коэффициенты давления всех газов одинаковы и равны
Закон, устанавливающий зависимость давления и температуры при неизменном объеме, называют законом Шарля.
Зависимость давления газа от температуры графически изображается прямой линией - изохорой.
Угол наклона изохоры по оси температур тем больше, чем меньше объем газа V3>V2>V1. В системах координат PV и VT изохора имеет вид прямой, параллельной оси P или T соответственно (учащиеся самостоятельно строят изохоры в осях P V и V T; затем проверка возле доски).
Таким образом, мы убедились в том, что основные газовые законы представляют собой частные случаи уравнения Клапейрона-Менделеева.
Интересно сопоставлять графики всех изопроцессов в различных системах координат
Из уравнения состояния, записанного в форме можно получить два следствия:
1) Во многих случаях мы имеем дело со смесью различных газов, поэтому весьма важно уметь вычислять давление этой смеси.Пусть в сосуде объемом V находятся различные газы, не реагирующие химически друг с другом. Т.к. все они находятся при одинаковой температуре, то основное уравнение можно записать так:
![]() , где N1
N2 :Nn числа молекул отдельных газов
, где N1
N2 :Nn числа молекул отдельных газов
Очевидно, что N1 + N2 +:+N n общее число молекул в сосуде
Давление газа ![]()
Каждое из выражений: ![]() ;
; ![]() ;
; ![]() - представляет
собой давление отдельного входящего в состав
смеси газа, т.н. парциальное давление, т.е. такое
давление, какое оказывал бы входящий в смесь газ,
если бы он один занимал весь предоставленный
смеси объем.
- представляет
собой давление отдельного входящего в состав
смеси газа, т.н. парциальное давление, т.е. такое
давление, какое оказывал бы входящий в смесь газ,
если бы он один занимал весь предоставленный
смеси объем.
Таким образом, P=P1+P2+ :+Pn ,т.е.давление смеси газов равно сумме парциальных давлений. Это закон Дальтона. Он показывает, что каждая группа молекул оказывает давление, не зависящее от того, какое давление производят другие молекулы.
2) ![]() При
равных давлениях и температуре в одинаковых
объемах любых газов содержится одинаковое число
молекул - закон Авогадро.
При
равных давлениях и температуре в одинаковых
объемах любых газов содержится одинаковое число
молекул - закон Авогадро.
II. Вопросы учащимся.
Проанализировав все, что узнали на уроке, ответить на следующие вопросы:
При осуществлении какого процесса увеличение абсолютной температуры идеального газа в 2 раза приводит к увеличению давления идеального газа тоже в два раза?
На рисунке представлен график зависимости давления данной массы идеального газа от температуры. Назвать процессы 1-2; 2-3; 3-1.
Идеальный газ перевели из состояния 1 в состояние 2. Нагревался или охлаждался газ данной массы в течение этого процесса?
III. Подведение итогов урока.
IV. Домашнее задание.
Параграф 71, записи в тетради.