Цели урока. Обобщить представление о химической реакции как о процессе превращения одного или нескольких исходных веществ-реактивов в отличающиеся от них по химическому составу или строению вещества — продукты реакции. Рассмотреть некоторые из многочисленных классификаций химических реакций по различным признакам. Показать применимость таких классификаций для неорганических и органических реакций. Раскрыть относительный характер различных типов химических реакций и взаимосвязь различных классификаций химических процессов.
Понятие о химических реакциях, их классификация по различным признакам в сравнении для неорганических и органических веществ
Химическая реакция — это такое изменение веществ, при котором разрываются старые и образуются новые химические связи между частицами («томами, ионами), из которых построены вещества (слайд 2).
Химические реакции классифицируются:
1. По числу и составу реагентов и продуктов (слайд 3)
а) разложения (слайд 4)
Реакции разложения в органической химии, в отличие от реакций разложения в неорганической химии, имеют свою специфику. Их можно рассматривать как процессы, обратные присоединению, поскольку в результате чаще всего образуются кратные связи или циклы.
б) соединения (слайд 5)
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
в) замещения (слайд 6)
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
г) обмена (в том числе и нейтрализации) (слайд 7)
Рекомендуется провести в форме лабораторной работы согласно уравнений реакций, предложенных в презентации
2. По тепловому эффекту (слайд 8)
а) эндотермические
б) экзотермические (в том числе и реакции горения)
В презентации предложены реакции из неорганической и органической химии Реакции соединения будут реакциями экзотермическими, а реакции разложения — эндотермическими (относительность этого вывода подчеркнет редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + 02 —> 2NO - Q
3. По использованию катализатора (слайд 9)
а) каталитические (в том числе и ферментативные)
б) некаталитические
4. По направлению (слайд 10)
а) каталитические (в том числе и ферментативные)
б) некаталитические
5. По фазе (слайд 11)
а) гомогенные
б) гетерогенные
6. По изменению степени окисления элементов, образующих реагенты и продукты (слайд 12)
а) окислительно-восстановительные
б) без изменения степени окисления
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. В более обобщенном варианте (уже с учетом и органической химии): все реакции с участием простых веществ. И наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
Закрепление изученной темы (слайд13-21).
Итог урока.
Выводы.
Урок 2. «Карбоновые кислоты: классификация и номенклатура, строение карбоксильной группы, физические, химические свойства, способы получения предельных одноосновных карбоновых кислот» (Слайд 1).
Цели урока. Дать понятие о карбоновых кислотах и их классификации в сравнении с минеральными кислотами. Рассмотреть основы международной и тривиальной номенклатуры и изомерию этого типа органических соединений. Разобрать строение карбоксильной группы и спрогнозировать химическое поведение карбоновых кислот. Рассмотреть общие свойства карбоновых кислот в сравнение со свойствами минеральных кислот. Дать понятие об особенных свойствах карбоновых кислот (реакции по радикалу и образование функциональных производных). Познакомить учащихся с наиболее характерными представителями карбоновых кислот и показать их значение в природе и в жизни человека.
Понятие о карбоновых кислотах, их классификация по различным признакам
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых кислот соответствует общей формуле (Слайд 2)
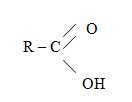
Карбоновые кислоты классифицируются:
По числу карбоксильных групп карбоновые кислоты делятся на (Слайд 3):
- монокарбоновые или одноосновные (уксусная кислота)
- дикарбоновые или двухосновные (щавелевая кислота)
В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты делятся на:
- алифатические (уксусная или акриловая)
- алициклические (циклогексанкарбоновая)
- ароматические (бензойная, фталевая)
Примеры кислот (Слайд 4)
Изомерия и строение карбоновых кислот
1.Изомерия углеродной цепи (Слайд 5)
2. Изомерия положения кратной связи, например:
СН2 = СН – СН2 – СООН Бутен-3-овая кислота (винилуксусная кислота)
СН3 – СН = СН – СООН Бутен-2-овая кислота (кротоновая кислота)
3. Цис-, транс-изомерия, например:
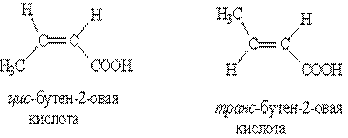
Строение (Слайд 6)
Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН.
В группе СО атом углерода несет частичный положительный заряд и притягивает к себе электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
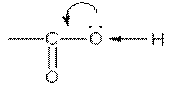
В свою очередь, группа ОН "гасит" положительный заряд на группе СО.
Физические и химические свойства карбоновых кислот
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой
С8Н17СООН — твердые вещества, без запаха, нерастворимые в воде.
Наиболее важные химические свойства, характерные для большинства карбоновых кислот (Слайд 7,8):
1) Взаимодействие с активными металлами:
2 CH3COOH + Mg![]() (CH3COO)2 Mg + H2
(CH3COO)2 Mg + H2
2) Взаимодействие с оксидами металлов:
2СН3СООН + СаО![]() (СН3СОО)2Са + Н2О
(СН3СОО)2Са + Н2О
3)Взаимодействие с основаниями:
CH3COOH + NaOH![]() CH3COONa + H2 O
CH3COONa + H2 O
4) Взаимодействие с солями:
CH3COOH + NaHCO3![]() CH3COONa + СО2 + Н2О
CH3COONa + СО2 + Н2О
5) Взаимодействие со спиртами (реакция этерификации):
CH3COOH + СН3СН2ОН![]() CH3COOСН2СН3 + H2O
CH3COOСН2СН3 + H2O
6) Взаимодействие с аммиаком:
CH3COOH + NH3![]() CH3COONH4
CH3COONH4
При нагревании аммонийных солей карбоновых кислот образуются их амиды:
CH3COONH4![]() CH3CONH2 + H2O
CH3CONH2 + H2O
7) Под действием SOCl2 карбоновые кислоты превращаются в соответствующие хлорангидриды.
CH3COOH + SOCl2![]() CH3COCl + HCl + SO2
CH3COCl + HCl + SO2
4. Межклассовая изомерия: например: С4Н8О2
СН3 – СН2 – СО – О – СНз метиловый эфир пропановой кислоты
СН3 – СО – О – CH2 – СН3 этиловый эфир этановой кислоты
С3Н7 – СООН бутановая кислота
Способы получения карбоновых кислот (Слайд 9,10)
1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот:
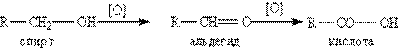
2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
![]()
3NaCl
3. Взаимодействие реактива Гриньяра с СО2:
![]()
4. Гидролиз сложных эфиров:
![]()
5. Гидролиз ангидридов кислот:
![]()
Способы получения карбоновых кислот
Для отдельных кислот существуют специфические способы получения (Слайд 11):
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:

Уксусную кислоту получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха:
![]()
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
![]()
Применение карбоновых кислот (Слайд 12)
Закрепление изученной темы (слайд13-14).
Итог урока.
Выводы.