Ступень обучения: III (X класс).
Характер ориентации: средний уровень.
Ведущий принцип: деятельностный, коммуникативный.
Содержательный уровень: обучающий, обобщающий, общеразвивающий.
Метод–доминанта: проблемно-поисковый.
Триединая цель урока:
1) Образовательный аспект
- Актуализировать и обобщить ранее полученные учащимися знания об основных классах неорганических соединений.
- Закрепить умения учащихся составлять уравнения химических реакций с участием амфотерных гидроксидов.
- Продолжить формирование у учащихся понятия «амфотерности».
2) Развивающий аспект
- Показать возможность применения своих знаний при решении качественных задач и выполнении упражнений.
- Продолжить формирование навыков познавательной деятельности, путем объяснения поставленного перед учащимися проблемного опыта.
- Продолжить формирование умения сравнивать, анализировать и сопоставлять результаты проведенных опытов;
- Формирование умения проводить аналогии между различными объектами;
- Развитие внимания и памяти.
- Развитие экспериментальных навыков.
3) Воспитывающий аспект
- Формирование научного мировоззрения.
- Формирование культуры учебного труда.
- Обратить внимание на эстетику учебной и трудовой деятельности при выполнении опытов.
- Воспитание культуры общения, умения взаимодействовать в паре;
- Формирование у учащихся культуры умственного труда, аккуратности в выполнении заданий и написании формул.
- Воспитание человека как части природы и общества, подчиняющегося их законам.
Оборудование и реактивы: растворы хлорида цинка, гидроксида натрия, аммиака, хлорида алюминия, соляной кислоты, хлорида магния, хлорида натрия; пробирки.
Ход урока
1. Организационный момент
2. Повторение пройденного материала
Индивидуальный опрос у доски:
- первый ученик – « Химические свойства кислот»
- второй ученик – « Химические свойства оснований».
В это время класс выполняет задание: с какими из перечисленных веществ будет реагировать гидроксид натрия, а с какими соляная кислота?
Написать возможные уравнения реакций.
Вещества: HNO3, CaO , CO2 , СuSO4 , Cu(OH)2 , P2O5 , ZnO, AgNO3 .
Затем один ученик выполняет это задание на доске, а остальные проверяют.
На доске:
| 1. | NaOH + HNO3 = NaNO3 + H2O 2 NaOH + ZnO |
| 2. | 2HCl + CaO = CaCl2 + H2O 2HCl + Cu(OH)2 = CuCl2 + 2H2O 2HCl + ZnO = ZnCl2 + H2O HCl + AgNO3 = AgCl + HNO3 |
3. Изучение нового материала
Тема урока: «Амфотерные гидроксиды».
Девиз урока: «Химия – наука полутонов».
Э.Е. Нифантьев.
Актуализация знаний
Учитель: Тема нашего урока «Амфотерные гидроксиды». Наша задача знать, какие соединения называют амфотерными гидроксидами и каковы их химические свойства; понять, в чем причина амфотерности; уметь писать уравнения реакций, отражающих химические свойства амфотерных гидроксидов.
Итак, давайте вспомним, что вы уже знаете об «амфотерности».
Ученик: Амфотерные соединения проявляют одновременно и основные, и кислотные свойства.
Учитель: Мы уже познакомились с амфотерными оксидами. Скажите, пожалуйста, какие элементы образуют эти соединения?
Ученик: Металлы в степени окисления +3 и +4,а также металлы, металлические свойства которых выражены неярко (в периодической системе элементов они находятся между металлами и неметаллами, вдоль диагонали). Например: Be, Zn, Ge и др.
Физические свойства амфотерных гидроксидов
Учитель: Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого цвета.
Получение
Учитель: Предположите способ получения амфотерных гидроксидов, помня, что они не растворимы в воде.
Ученик: Реакцией обмена между растворимой солью соответствующего металла и щелочью. (Демонстрационный эксперимент)
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Zn2+ + 2OH - = Zn (OH)2
Учитель: Но! Избыток щелочи может растворить образовавшийся осадок, поэтому берут слабое основание – NH3 * H2O ( гидроксид аммония или гидрат аммиака).
![]()
Химические свойства
Учитель: Известная мудрость гласит: «Опыт- путь к познанию». Поэтому химические свойства амфотерных гидроксидов вы определите, выполняя лабораторный опыт в парах.
Задание: получить гидроксид алюминия и определить его химические свойства. Для этого у Вас на столах есть растворы хлорида алюминия, аммиака, соляной кислоты и гидроксида натрия. Помните о соблюдении правил техники безопасности.Запишите уравнения химических реакций.
Ученики выполняют опыт, записывают в тетрадях уравнения реакций.
Один ученик выходит к доске и записывает все уравнения и объясняет наблюдаемые явления.
AlCl3 + 3NH3 * H2O = Al(OH)3 + 3NH4Cl
Как основание |
Как кислота |
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 +3H + = Al 3+ + 3H2O Образуются соли катионного типа |
Al(OH)3 + NaOH = Na[ Al(OH)4 ] тетрагидроксоалюминат натрия Al(OH)3 + OH - = [ Al (OH)4 ] – Образуются соли анионного типа |
Вывод: гидроксид алюминия взаимодействует и с кислотами, и с основаниями, т.е. проявляет амфотерные свойства.
Учитель: В чем же причина амфотерности этих соединений?
Для того чтобы ответить на этот вопрос, рассмотрим их диссоциацию.
В водных растворах амфотерные гидроксиды практически не диссоциируют, но в растворах кислот и щелочей могут диссоциировать двумя способами.
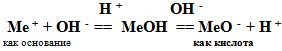
Учитель. Нужно отметить, что соли анионного типа, образующиеся при взаимодействии амфотерного гидроксида со щелочью, устойчивы в щелочной среде, но разрушаются при подкислении растворов.
Na [Al(OH)4 ] + 4HCl = NaCl + AlCl3 + 4H2O
Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются:
2Al(OH )3 ![]() Al2O3 + 3H2O
Al2O3 + 3H2O
4. Закрепление
Экспериментальная задача. Даны три пробирки с растворами хлоридов натрия, магния и алюминия. Как определить, в какой пробирке какое вещество?
Один участник выходит к демонстрационному столу и выполняет опыт.
| 1. | NaCl2 + NaOH =/= реакция не идет |
| 2. | MgCl2 + 2NaOH = Mg (OH)2 + 2NaCl – выпадает белый осадок, нерастворимый в щелочах. |
| 3. | AlCl3 + 3NaOH = Al (OH)3 + 3NaCl – выпадает белый осадок |
Al(OH)3 + NaOH = Na[ Al(OH)4 ] – осадок растворяется в избытке щелочи. |
5. Подведение итогов урока
Учитель: Итак, подводя итоги нашего урока, я хотела бы сказать, что амфотерность - категория не только химическая, но и философская: с греческого языка слово «amphoteros» переводится как « тот и другой », то есть это понятие означает единство противоположностей.
А это уже один из основных законов природы – закон единства и борьбы противоположностей, который проявляется практически в каждой химической реакции: кислота и основание, окислитель и восстановитель, донор и акцептор и так далее.
Этот закон объективен, его нельзя отменить, можно только воспользоваться им для объяснения явлений.
Мы часто в жизни сталкиваемся с проявлениями этого закона: в технике – противоположно заряженные частицы притягиваются; в человеческих отношениях – часто очень разные люди сближаются, они как будто дополняют друг друга. В жизни всегда борются добро и зло, в каждом человеке обязательно присутствуют плохие и хорошие черты. Поэтому не бывает человека идеального, только хорошего, а в самом падшем, плохом человеке всегда можно найти что-то доброе, светлое. Об этом надо всегда помнить и относиться к окружающим нас людям с пониманием, терпимостью к чужим недостаткам.
Тема нашего сегодняшнего урока является еще одним подтверждением связи химии с нашей жизнью. И теперь давайте вернемся к девизу этого урока: « Химия – это наука полутонов ». Как вы можете объяснить это выражение?
Ученик: Это значит, что нельзя провести четкую границу между простыми веществами металлами и неметаллами, разными классами соединений, органическими и неорганическими веществами. Все подчиняется единству материального мира.
6. Домашнее задание
Параграф 28.3, задания: 1,2,3 (учебник «Химия 10 класс» авторы: И.И.Новошинский, Н.С.Новошинская)
Дополнительное задание к уроку (если останется время)
Осуществить превращения:
Al-1- Al2O3 -2-- NaAlO2 -3-- Al (OH)3 -4-- Al2O3 |
1. 4Al + 3O2 = 2Al2O3
2. Al2O3 + Na2O ![]() 2NaAlO2
2NaAlO2
3. NaAlO2 + HCl + H2O = NaCl + Al(OH)3
4. 2Al(OH)3 ![]() Al2O3 +3H2O
Al2O3 +3H2O
AlCl3 --1-- Al(OH)3 -2--- Na[Al (OH)4] --3-- AlCl3 |
1. AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
2. Al(OH)3 + NaOH = Na[ Al(OH)4 ]
3. Na[ Al(OH)4 ]+ 4HCl = NaCl + AlCl3 + 4H2O