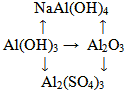Образовательные задачи: организовать работу по установлению характера оксида и гидроксида алюминия. Повторить и закрепить понятие амфотерности на примере свойств соединений алюминия. Повторить и закрепить понятие гидролиза на примере гидролиза солей алюминия.
Воспитательные задачи: воспитывать у учащихся самостоятельность, инициативность, исследовательскую компетентность в процессе организации самостоятельной поисковой деятельности. Воспитывать доброжелательность, умение работать в коллективе через организацию групповой работы.
Задачи развития: Формировать у учащихся умение определять цели и задачи учебной деятельности, анализировать изучаемый материал на основе имеющихся знаний, выдвигать гипотезу и подтверждать ее /теоретически и экспериментально/. Совершенствовать умение планировать свою деятельность, проводить эксперимент, наблюдать его и на основе наблюдений делать выводы и обобщения.
Структура урока

ХОД УРОКА
Учитель объявляет тему урока.
Учитель: Ребята, сегодня на уроке вы выступаете в роли исследователей. Новый материал вам предстоит изучать самостоятельно в ходе учебного исследования. Я уверена, что вы с успехом справитесь с этим, так как имеете все знания, необходимые для самостоятельного выполнения заданий по новой теме. Если у вас возникнут трудности, я всегда готова придти вам на помощь.
Учитель: Перед началом исследования мы с вами повторим вопросы, которые помогут вам успешно работать на уроке.
Актуализация знаний учащихся
Цель: актуализировать знания уч-ся о способе получения нерастворимого основания; о химических реакциях, подтверждающих амфотерные свойства соединений; о гидролизе солей, образованных слабыми основаниями.
На каждую парту выдается карточка
| I вариант | ||||
| 1 | KOH | FeCl2 + H2O | K2CO3 | Al + O2 → |
| 2 | Fe(OH)2 | FeO + H2O | FeSO4 | Al + H2SO4→ |
| 3 | NH4OH | FeCl2 + NaOH | KCl | Al + S → |
| 4 | Ba(OH)2 | Al + CuSO4→ | ||
| 5 | Al+ NaOH+ H2O | |||
| II вариант | ||||
| 1 | NaOH | CuO + H2O | CuCl2 | Al + Br2 → |
| 2 | Ba(OH)2 | CuSO4 + NaOH | NaNO3 | Al+ NaOH+ H2O |
| 3 | Cu(OH)2 | Cu + H2O | Na2SiO3 | Al + Fe2O2 → |
| 4 | LiOH | Al + HCl → | ||
| 5 | Al + HgSO4 → | |||
Вопросы для работы по карточке /спроецированы на экран/:
- Определите нерастворимое основание /1-й столбец/
- Определите способ получения нерастворимого основания /2-й столбец/
- Определите соли, которые подвергаются гидролизу /обоснуйте свой выбор, 3-й столбец/.
- Определите реакции, подтверждающие амфотерность алюминия /4-й столбец/.
Учитель организует фронтальное обсуждение данных вопросов по каждому варианту.
Учащиеся с места отвечают на вопросы по своему варианту. Весь класс следит за ответом, а при наличии ошибок в ответе, вносят поправки в ответ товарища.
Далее учитель предлагает учащимся выполнить письменное задание.
Задание:
1 вариант – записать уравнение реакции алюминия с серной кислотой;
2 вариант – записать уравнение реакции алюминия с гидроксидом натрия;
3 вариант – записать уравнение реакции гидролиза хлорида меди (II).
По одному ученику от каждого варианта выполняют задание на закрытой доске.
После выполнения учащимися задания учитель организует его самопроверку по записям на доске.
При подведении итога этапа актуализации знаний учитель предлагает учащимся ответить на вопросы:
- Как получить нерастворимое основание?
- Как доказать амфотерность соединения?
- Как определить соли, подвергающиеся гидролизу?
Постановка целей исследования
Учитель: Попробуйте самостоятельно, исходя из темы урока, определить цели предстоящей работы.
Ответы учащихся:
- Выяснить какой характер проявляет оксид алюминия.
- Выяснить какой характер проявляет гидроксид алюминия.
- Выяснить подвергаются ли соли алюминия гидролизу.
В ходе обсуждения определяются две основные цели, которые учащиеся записывают в тетради:
1.Определить характер оксида и гидроксида алюминия.
2.Установить, подвергаются ли соли алюминия гидролизу.
Учитель: В ходе исследования по решению поставленных задач, вы будете учиться выдвигать гипотезу и подтверждать ее /теоретически и экспериментально/, планировать свою деятельность, проводить эксперимент, наблюдать его и на основе наблюдений делать выводы и обобщения.
Проведение теоретического анализа и построение гипотезы
Учитель: На основе имеющихся у вас знаний выскажите предположения о характере оксида и гидроксида алюминия, о способности солей алюминия подвергаться гидролизу /обсуждение проводится в группах/.
Ответы учащихся /высказывают гипотезы/:
- Оксид алюминия проявляет амфотерные свойства.
- Гидроксид алюминия проявляет амфотерные свойства.
- Соли алюминия подвергаются гидролизу, так как гидроксид алюминия – слабое основание.
Составление плана экспериментальной проверки и его выполнение.
После формулирования гипотез группы получают задание для самостоятельной работы.
Задание: составить план экспериментальной проверки гипотез.
Учащиеся составляют план, работая в группах.
Учитель организует обсуждение планов, составленных группами.
В ходе обсуждения определяется следующий план экспериментальной проверки:
-
Подтверждение амфотерности оксида и гидроксида алюминия:
а) взаимодействие с кислотой;
б) взаимодействие со щелочью. -
Подтверждение гидролиза солей алюминия:
а) испытание реакции среды растворов солей алюминия индикатором.
Данный план проецируется на экран.
В соответствии с планом учащиеся проводят экспериментальную проверку выдвинутых гипотез. Эксперимент учащиеся выполняют в парах, его результаты обсуждают в группах.
Задания группам:
1-3 группы:
- провести подтверждение амфотерности оксида алюминия,
- испытать индикатором раствор хлорида алюминия.
4-6 группы:
- провести подтверждение амфотерности гидроксида алюминия,
- испытать индикатором раствор нитрата алюминия.
Учащиеся проводят эксперимент, его результаты оформляют в таблицу:
- что делали
- что наблюдали
- выводы и уравнения реакций /в молекулярной и ионной форме/.
Обсуждение результатов и формулирование вывода.
По каждому заданию отчитывается одна из групп по плану:
- проведенные реакции
- наблюдения
- уравнения реакции
- выводы
Остальные учащиеся слушают, дополняют, исправляют ошибки, если они есть, делают дополнительные записи в тетради.
Учитель предлагает учащимся сформулировать общий вывод, исходя из целей исследования.
Под руководством учителя учащиеся формулируют общие выводы.
Ответы учащихся:
- Оксид и гидроксид алюминия проявляют амфотерные свойства и взаимодействуют с кислотами и основаниями.
- Соли алюминия подвергаются гидролизу, так как гидроксид алюминия является слабым основанием.
Подведение итогов работы учащихся на уроке
Учащиеся в группах проводят взаимооценку деятельности друг друга и данные сдают учителю.
Рефлексия деятельности – ученики отвечают на вопросы:
- Что я делал?
- С какой целью?
- Достиг ли поставленной цели?
Учитель подводит общий итог урока, отмечает организованную работу групп, благодарит учащихся за активную работу.
Домашнее задание /на выбор учащихся/:
1 вариант
Закончить уравнения реакций:
- Al2O3 + H2SO4 →
- Al(OH)3 + HNO3 →
- Al2O3 + KOH →
- Al(OH)3 + LiOH →
2 вариант
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3 вариант
Закончить уравнения практически осуществимых реакций в молекулярном и ионном виде:
- Al(OH)3 + OH- →
- Al2O3 + H+ →
- CaCl2 + Al →
- Al3+ + OH- →
Структура урока, включающего исследование свойств веществ, взята из книги «Система самостоятельных работ учащихся при изучении неорганической химии». Авторы Р. Г. Иванова, А. Г. Иодко. М.: Просвещение, 1988.