Тип урока: изучение новых знаний.
Вид урока: лабораторная работа.
Цели урока
Обучающие:
- изучить понятие "реакция замещения", его сущность;
- научить учащихся писать уравнения реакций замещения;
- формировать умение предсказывать продукты реакций замещения;
- дать первоначальное понятие об электрохимическом ряде напряжений металлов.
Развивающие:
- развивать умение ставить несложную проблему, формулировать гипотезу и проводить её опытную проверку, опираясь на знания химии;
- совершенствовать умения работать с лабораторным оборудованием и реактивами;
- продолжить формирование умения оформлять результаты учебного эксперимента;
- развивать способность к адекватному само- и взаимоконтролю.
Воспитательные:
- продолжить формирование научного мировоззрения учащихся;
- воспитывать культуру общения через работу в парах "ученик-ученик", "учитель-ученик";
- воспитывать у учащихся такие качества личности, как наблюдательность, внимание, пытливость, инициатива.
Методы и методические приёмы:
- лабораторная работа;
- фронтальный опрос;
- самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок;
- работа со средствами наглядности: Периодической системой химических элементов Д.И.Менделеева, карточками.
Оснащение урока:
- кодоскоп;
- карточки с заданиями для самостоятельной работы по теме "Реакции разложения и соединения";
- карточки с таблицей "Классификация реакций на основании количества и состава реагирующих веществ".
Оборудование и реактивы:
- лабораторный штатив с пробирками,
- кристаллизатор,
- прибор для получения водорода,
- лучинка,
- спички;
- цинк и магний в гранулах,
- железный гвоздь,
- медная проволока,
- растворы соляной кислоты,
- хлорида меди (II),
- хлорида железа (III).
Ход урока
I. Вхождение в урок.
Учитель: Здравствуйте, ребята! Вот мы и снова встретились в кабинете химии. А какое у вас сегодня настроение? (Используется приём "Мордашки"). Запишите сегодняшнее число; тему урока и нарисуйте мордашку, характеризующую ваше настроение.
Учитель: Поднимите руки, у кого хорошее настроение; среднее настроение; плохое настроение. (Это количество будет необходимо на завершающей стадии урока). Думаю, что сегодняшний урок вам понравится, вы узнаете много нового, и вам не будет скучно, потому что сегодня вы будете сами проводить опыты. Но для начала проверим, как вы усвоили материал, изученный на прошлом уроке.
II. Актуализация знаний.
Фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (1аб; 2г с. 100)
Учитель: На прошлом уроке вы познакомились ещё с одной классификацией химических реакций. По каким признакам мы классифицировали реакции в прошлый раз?
Ученик: Мы классифицировали реакции по количеству вступивших и образовавшихся веществ и по их составу.
Учитель: С какими типами реакций вы познакомились?
Ученик: С реакциями разложения и соединения.
Учитель: Дайте определение реакции разложения.
Ученик: Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель: Какая реакция называется реакцией соединения?
Ученик: Реакцией соединения называется реакция, в результате которой из двух и более простых или сложных веществ образуется одно сложное вещество.
Учитель: Скажите, пожалуйста, для чего в схемах химических реакций мы расставляли коэффициенты?
Ученик: Для того чтобы соблюдался закон сохранения массы веществ.
Учитель: Давайте проверим, как это получилось у ваших товарищей (идёт проверка домашних упражнений, ученики задают дополнительные вопросы отвечающим, выставляются оценки).
Задание 1а, б с.100
Запишите в виде химических уравнений следующие предложения: а) "При обжиге карбоната кальция образуется оксид кальция и оксид углерода (IV)"; б) "При взаимодействии оксида фосфора (V) с водой образуется фосфорная кислота". Каков тип указанных реакций? Какая из них будет экзо- , а какая эндотермической?
Решение
- СаСО3 -> СаО + СО2 - реакция разложения, эндотермическая
- Р2О5 + 3Н2О ->2Н3РО4 - реакция соединения, экзотермическая
Задание 2г с.100
Составьте уравнение по следующей схеме и укажите тип реакции:
- СuOH -> Cu2O + H2O.
Под формулами веществ напишите их названия.
Решение
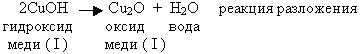
Учитель: Теперь каждому предлагается выполнить задание расставить коэффициенты в схемах химических реакций.
III. Самостоятельная работа (8-10 минут).
Задание: Расставьте коэффициенты, укажите тип химических реакций.
Вариант I Вариант II 1. MgO + CO2 -> MgCO3 1. KNO3 -> KNO2 + O2 2. NO2 + O2 + H2O -> HNO3 2. SO2 + O2 -> SO3 3. Na2O + H2O -> NaOH 3. SO3 + H2O -> H2SO4 4. KClO3 -> KCl + O2 4. K2O + H2O -> KOH 5. CO + O2 -> CO2 5. NO + O2 -> NO2
Учитель: Ребята, поднимите руку, кто выполнил работу на "5"? на "4"? Итак, сегодня вы познакомитесь ещё с одним типом химических реакций - реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться в результате реакций замещения, и потренируетесь в расстановке коэффициентов.
IV. Изучение нового материала.
Фронтальная беседа:
Учитель: Итак, реакция замещения. Какие ассоциации вызывает у вас название этого типа реакций? (Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим).
Учитель: Каким по составу должно быть вещество, которое замещает - простым или сложным?
Ученик: Простым.
Учитель: Тогда каков должен быть состав вещества, в котором происходит замещение?
Ученик: Это вещество должно быть сложным, чтобы атомы одного элемента можно было заместить, а атомы других элементов остались.
Учитель: Давайте обозначим простое вещество А, сложное вещество ВС. Как в этом случае можно записать общую схему реакции замещения? (ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу, которую начали заполнять на прошлом уроке).
Таблица "Классификация реакций на основании количества и состава реагирующих веществ"
| Тип реакции | Уравнение реакции в общем виде. Количество и состав веществ |
|
| вступивших в реакцию | получившихся в результате реакции | |
| Реакция соединения |
Несколько простых | Сложное вещество |
| А + В = АВ | ||
| или сложных веществ | Другое сложное вещество | |
| АВ + СВ = АВ2С | ||
| Реакция разложения |
Сложное вещество | Несколько простых веществ |
| АВ = А + В | ||
| или сложных веществ | ||
| АВ2С = АВ + ВС | ||
| Реакция замещения | Сложное вещество и простое | Другое сложное вещество и другое простое |
| А + ВС = В + АС | ||
| Реакция обмена | ||
Учитель: Значит, реакцией разложения называется реакция, в которой участвует одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуется новое простое и новое сложное вещество. (запись определения в тетрадь).
Учитель: Но гипотеза, это только наше предположение, давайте подтвердим её практически или опровергнем. Для этого проведём лабораторную работу. (Учащиеся получают карточки с таблицей для составления отчёта по лабораторной работе "Реакции замещения"). В таблице заполнена первая графа, дающая представление о том, что нужно сделать. Вторую и третью графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспоминаем, что работать с растворами кислот нужно осторожно, так как они опасны. С растворами нужно работать по принципу "Не разлей", с твёрдыми веществами - по принципу "Не рассыпь". Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта №1.(учащиеся выполняют работы, пользуясь текстом учебника).
Фронтальная беседа (обсуждение результатов опыта).
Учитель: Можем ли мы сказать, что произошла химическая реакция?
Ученик: Да, так как выделился газ.
Учитель: Давайте составим уравнение этой химической реакции и предположим, какие вещества образовались в результате этой химической реакции. (учитель у доски объясняет принцип составления уравнений реакций такого типа и просит ребят расставить коэффициенты).
Учитель: По уравнению химической реакции видно, что получился газ водород, но как доказать это практически. Открою вам маленький секрет - вы сейчас прошли тем самым путём, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории. Но водород ещё нужно было собрать. Догадайтесь, как собрать водород в другую пробирку.
Ученик: Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку?
Учитель: Что находится в пустой пробирке?
Ученик: Воздух.
Учитель: Посмотрите в таблицу Менделеева, найдите относительную молекулярную массу водорода и скажите, что будет легче: водород или воздух?
Ученик: Водород, потому что его относительная молекулярная масса равна двум.
Учитель: В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ называется способом вытеснения воздуха.
Давайте посмотрим, как получил и собрал водород Генри Кавендиш, а также каким образом он определил, что это именно водород. (демонстрационный опыт).
Учитель: Теперь приступайте к выполнению следующего опыта. (смотреть текст учебника).
Фронтальная беседа (обсуждение результатов опыта).
Учитель: Можем ли мы сказать, что произошла химическая реакция?
Ученик: Да, так как выделился газ.
Учитель: Предположите, какой газ выделился в результате этой химической реакции?
Ученик: Водород, так как магний замещает атомы водорода в соляной кислоте.
Учитель: Самостоятельно составьте уравнение этой химической реакции и расставьте в нём коэффициенты (проверка через кодоскоп).
Учитель: Сравните скорость взаимодействия магния и цинка с соляной кислотой.
Оказывается, что скорость взаимодействия металла с кислотой зависит от активности металла. Активность металлов определена, и все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов.
Учитель: Посмотрите внимательно, какой неметалл занесён в этот ряд?
Ученик: Водород.
Учитель: Оказывается, что металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Сможет ли медь вытеснить водород из раствора соляной кислоты?
Ученик: Нет, так как медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель: (Демонстрация опытов и подтверждение выдвинутой гипотезы). Мы с вами можем сделать вывод, что электрохимический ряд напряжений металлов позволяет предсказывать не только продукты реакций, но и возможна ли данная реакция или нет.
Учитель: А теперь приступайте к выполнению опытов № 3,4. (смотреть текст учебника).
Фронтальная беседа (обсуждение результатов опыта):
Учитель: Что вы увидели при проведении этих опытов?
Ученик: Первая реакция произошла, так как гвоздь покрылся красным налётом, а вторая - нет, так как никаких изменений не произошло.
Учитель: Почему невозможна вторая реакция?
Ученик: Так как медь в электрохимическом ряду напряжений металлов находится после железа, значит, она менее активна и не может его вытеснить.
Учитель: Запишите уравнение взаимодействия железа с хлоридом меди (II). (Результаты работы проверяются с помощью кодоскопа).
Итак, сегодня вы познакомились ещё с одним типом химических реакций - реакцией замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнение.
V. Закрепление.
Учитель: На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие - нет. Почему? (Спрашивать по одному ученику на каждое уравнение).
Учитель: Расставьте коэффициенты в схемах возможных химических реакций. (Класс работает самостоятельно, к доске вызываются два ученика для расстановки коэффициентов, затем идёт проверка результатов работы).
Задание:
Fe + HCl ->
Ответ:
- Fe + 2HCl FeCl2 + H2 ->
- 2AgNO3 + Cu Cu(NO3)2 + 2Ag ->
- CuO + H2 H2O + Cu ->
- 2Al + 3FeSO4 Al2(SO4)3 + 3Fe ->
VI. Заключительная часть.
Давайте ещё раз выясним, у кого какое настроение - нарисуйте мордашку, характеризующую ваше настроение. (Далее - обратная связь и анализ полученных результатов).
Домашнее задание. Параграф 27, упр. 2а, 3в (с. 100).