Цель: изучить состав, строение и свойства серной кислоты; сформировать представления о физических и химических свойствах серной кислоты; Опираясь на знание общих химических свойств кислот, сформировать понятие о химических свойствах разбавленной и концентрированной серной кислоты; конкретизировать знания о качественной реакции на сульфат.
Задачи:
- Учебно-образовательные: актуализация опорных знаний и умений по теме: «Физические и химические свойства серной кислоты».
- Учебно-развивающие: развитие логического мышления, умения делать обобщающие выводы, умения анализировать, выработка внимания, развитие речи, развитие познавательной активности, совершенствование экспериментальных навыков и умений.
- Учебно-воспитательные: формирование у учащихся материалистического мировоззрения.
Методы:
- Практические: работа с химическими реактивами, со спиртовкой, с таблицами, тестовый контроль, составление опорного конспекта.
- Наглядные: демонстрация опытов, электронной презентации.
- Словесные: беседа, устные изложения, работа по плану.
Методические приемы:
- Логические (сравнение, выводы, обобщение)
- Организационные (ответы у доски, тест, фронтальная работа, работа в группах, воспроизведение работы при ответе)
- Технологические (демонстрационные опыты, подтверждающие физические и химические свойства серной кислоты.)
Литература:
- Л. С. Гузей, Р. П. Суровцева Химия 9 класс.,
- Г. П. Хомченко Химия для поступающих в вуз. М. « Высшая школа » 1994год.
- Справочник школьника «Химия», М. 1995 год .
- Л. С. Гузей, Р. П. Суровцева Методические указания (9 класс)
Оборудование: H2SO4 конц. Н2SO4 разб, ; индикаторная бумага, Mg, СuО; NaOH, фенолфталеин; ВаС12 сахар, спиртовка.
Структура урока
- Орг. момент (2 мин.).
- Изучение нового материала (25 минут).
- Закрепление нового материала (12 мин).
- Домашнее задание (1 минута).
2. Изучение нового материала.
Перед сообщением новой темы задаю химическую загадку: по заданным приметам отгадать, о какой особе идет речь.
Очень известная особа. Родоначальница огромного семейства Сульфатов и Гидросульфатов. Тучна, масляниста, имеет большую плотность. Страдает пристрастием к воде и даже отнимает её у других, готова принимать её в любых количествах. Но начинает злиться, шипеть и клеваться, если кто-то пытается влить воду в неё насильно. В больших количествах её не способен вынести никто! Агрессивна и неуживчива, вытесняет некоторые вещества из их привычных соединений. Обожает стряпать самые разнообразные соли. Из-за скверного характера имеет недоброжелателей, которые в её присутствии чернеют от злости или даже обугливаются. (Серная кислота)
- Тема записана на доске (сообщается уч-ся).
Учитель: Сегодня на уроке наша основная задача заключается в том, чтобы по плану (записанному на доске) дать более полную характеристику этой известной особе - серной кислоте.
Демонстрация электронной презентации по всем пунктам плана осуществляется параллельно с работой учащихся.
План.
- Молекулярная формула.
- Структурная формула.
- Характер связей в молекуле.
- Физические свойства.
- Химические свойства:
а) разбавленной серной кислоты.
б) концентрированной.
- Для нашей успешной работы классу необходимо разбиться на 3 группы (по уровню успеваемости).
- теоретики (сильные уч-ся) (т)
- практики (слабоуспевающие уч-ся) (п)
- эксперты (успевающие на "хорошо"). (э)
Теоретики будут помогать в решении теоретических вопросов, практики - осуществлять демонстрационные опыты; эксперты будут следить за правильностью ответов и соблюдением техники безопасности при проведении опытов.
Наша задача актуализировать знания по физическим и химическим свойствам серной кислоты, применить их для изучения новой темы.
Работа по плану: учащиеся (теоретики) выходят к доске, делая записи по каждому пункту, комментируют их. Учитель по ходу урока делает необходимые разъяснения, уточнения.
- Молекулярная формула:
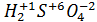 (с указанием степени окисления элементов)
(с указанием степени окисления элементов) - Структурная формула: (Смотреть приложение)
- Характер связей в молекуле - ковалентные полярные.
- Физические свойства (учитель)
Безводная серная кислота - жидкость, плотность которой примерно в два раза превышает плотность воды (р=1,83 г/см), без цвета и запаха. Она смешивается с водой в любых соотношениях. Процесс растворения сопровождается выделением? (теплоты)
Вопрос: О чём это свидетельствует? (Об образовании с водой химических соединений – гидратов, существование которых доказал в 80-х годах 19 века Д. И. Менделеев, который считал, что растворение – не только физический, но и химический процесс).
Вопрос: какое правило необходимо соблюдать при растворении серной кислоты концентрированной в воде? (смотреть приложение)
Правило: (запись в тетрадь) прибавлять кислоту в воду, а не наоборот.
5. Химическое свойства Н2S04.
а) разбавленной (типичные свойства кислоты)
- сильный электролит (изменяет окраску индикаторов - как?)
Т. Ступенчатая диссоциация (т.к. кислота многоосновная)
П. Демонстратирует действие у. инд. бумаги на р-р Н2SO4.
- Взаимодействует с Me до Н.
Т. ![]()
П. демонстрируют эту реакцию. Отмечают наблюдения
![]()
- взаимодействует с основными и амфотерными оксидами.
Т. ![]()
П. демонстрируют опыт
(необходимо t). Наблюдения
- взаимодействует с основаниями амфотерными гидроксидами.
Т. ![]()
П. при выполнении опыта щелочь подкрасить фенолфталеином. Наблюдения.
- Как сильный электролит вытесняет любую другую (более слабую) кислоту из ее соли.
![]()
П. Выполняют опыт и делают наблюдения.
- Распознавательная реакция на сульфат-ион – действие хлорида бария.
![]()
П. Выполняют опыт и делают наблюдения
б) Химические свойства концентрированной ![]() (вывешивается плакат, учащиеся делают записи в тетрадь).
(вывешивается плакат, учащиеся делают записи в тетрадь).
- Сильный окислитель.
- Окисляет (обугливает) органические вещества. (уравнение пишет учитель, опыт демонстрирует учитель)
![]()
- При нагревании выт-т летучие к-ты из сухих солей (учитель)
![]()
- При нагревании реагирует со всеми Ме, кроме Pt; Au; (учитель записывает уравнение реакции на доске, а учащиеся составляют электронный баланс).
![]()
- (дополнительно) При t окисляет некоторые неметаллы до их оксидов, сама восстанавливается до ![]()
![]()
3. Закрепление нового материала - выполнение теста (в полутетрадях).
Учебник стр. 94-95
I В. №17, 20(а,б), |
|
|
II В № 18, 20(в,г). |
Ответы: №17 – б |
|
|
№18 - б |
№20 а) б) – |
|
|
№20 в) г) – в |
4. Домашнее задание и выставление оценок за урок.
19.4, т. 19.1 (3 графа), конспект.
На «5» - в выполненных тестах составить уравнения возможных реакций.
I В. №17, 20(а,б), II В № 18, 20(в,г).
Учебник стр. 94-95