Цель: Сформировать у учащихся представление о том, что свойства гидроксогруппы в соединении могут меняться в зависимости от характера соединенного с ней углеводородного радикала и что свойства самого радикала так же меняется под влиянием функциональной группы. Четко разграничить фенолы и спирты.
Образовательная: конкретизация и применение основных химических понятий и законов, изученных в предыдущих темах; закрепление представленных о взаимном влиянии атомов внутри молекулы фенола, о взаимосвязи различных классов веществ; области использования фенола.
Развивающая: использование межпредметных связей (биология); развивать познавательный интерес и эмоции школьников, умение выделять главное, сравнивать, обобщать, логически излагать; связь химии с различными отраслями народного хозяйства (медицина, Гусиноозерская ГРЭС, Селенгинский).
Воспитательная: обучение учащихся работе с лабораторным оборудованием; формирование умения проводить эксперименты, наблюдать, анализировать и делать выводы; соблюдение правил техники безопасности при работе в химическим кабинете; обсуждение проблем охраны окружающей среды и возможных последствий загрязнения и для природы и общества.
Оборудование: на демонстрационном столе: фенол, натрий, прибор для получения оксида углерода (IV); раствор гидроксида натрия, хлорида железа (III); масштабная модель фенола. На столах у учащихся: вода, растворы гидроксида натрия, хлорида железа(III), спиртовой раствор ф/ф, спирт, спиртовка, держатель, чайная заварка, зеленое яблоко.
Тип урока: Урок усвоения и систематизации новых знаний.
Метод: объяснительно-иллюстративный, частично-поисковый.
На данном уроке используется проблемный подход в сочетании с демонстрационным и лабораторным экспериментом, проводится обобщение знаний.
Х О Д У Р О К А
I. Актуализация.
1. Укажите к каким классам соединений относятся вещества следующего строения.
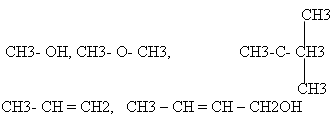
2. Какие соединения относятся к спиртам?
3. Какое строение имеют спирты?
II. Изучение нового материала.
Учитель. А не могли вы сказать не подходят ли под эту формулу R – ОН уже известные вам классы соединений?
Учащиеся. Да, известно. Н-ОН, Na- ОН, СН3- ОН, С6Н5- ОН
Учитель. А если они встречались не относятся ли они к одному общему классу?
Учащиеся. Нет.
Учитель. Почему?
Учащиеся. Потому что каждая функциональная группа проявляет разные свойства внутри молекулы, потому что внутримолекулярное влияние бывает обоюдным.
1. История открытия фенола.
В 1834г. немецкий химик-органик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом. Ему не удалось определить состав вещества, сделал это в 1842г. Огюст Лоран. Вещество обладало выраженными кислотными свойствами и было производным открытого незадолго до этого бензола. Лоран назвал его бензол феном, поэтому новая кислота получила название фениловой. Шарль Жерар считал полученное вещество спиртом и предложил называть его фенолом.
Сегодня нам интересно знать к какому классу соединений относятся фенолы? Ведь они тоже отвечают формуле R- ОН?
2. Из каких двух уже знакомых фрагментов состоит молекула фенола
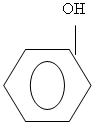
Из бензола и гидроксильной группы.
Учитель. Свойствами каких соединений формально должен обладать фенол?
Учащиеся. Бензола и спирта.
Рассмотрим электронное строение фенола.
Подобно метильной группе в толуоле, гидроксильная группа также взаимодействует с электронами ароматического кольца, но более ярко выражено.
За счет взаимодействия р-орбитали атома кислорода с неподеленной электронной парой и П-системы бензольного кольца. Неподеленная электронная пара атома кислорода вовлекается в ароматическое сопряжение и тем самым увеличивает электронную плотность в кольце. Кроме этого, влияние группы – ОН на бензольное кольцо выражается и в перераспределении в нем электронной плотности в орто и пара – положениях. В свою очередь, фенильный заместитель обедняет атом кислорода электронной плотностью, увеличивая тем самым полярность связи О-Н и кислотность фенолов по сравнению со спиртами.
Вывод:
- Гидроксогруппа увеличивает общую электронную плотность в ароматическом кольце.
- Увеличение электронной плотности в орто и пара- положениях.
- Бензольное кольцо увеличивает полярность связи О-Н, усиливая ее кислотные свойства.
Гомологический ряд фенолов: (презентация)
Работа с учебником: $ 18 с 155-156.
Физические свойства:
Демонстрационный эксперимент: кристаллическое вещество, с характерным запахом, плохо растворяется в холодной и хорошо в горячей воде, t пл.=43 гр.С, t кип.=181гр.С.Ядовит!
Химические свойства:
а) кислотные свойства:
Учитель. Так у какого вещества будут сильнее выражены кислотные свойства у спиртов или у фенолов?
Лабораторный эксперимент в паре. К спирту прилить немного щелочи, к которому добавлен ф/ф.
Учитель. Что наблюдаете?
Учащиеся? Отсутствие изменений окраски.
Вывод: спирт не взаимодействует с щелочью.
Демонстрационный эксперимент (вытяжка!). К эмульсии 0,5г фенола добавляем 10%-ный раствор гидроксида натрия, раствор становится прозрачным.
Учитель. Почему изменилась окраска?
Учащиеся. За счет присутствия ионов водорода.
Учитель. Откуда взялись ионы водороды?
Учащиеся. Фенол обладает свойством слабой кислоты.
Учитель. Чем можно заменить водород гидроксогруппы в феноле?
Запишите уравнение реакции.
2C6H5OH +2NaOH = 2C6H5ONa + H2
Учащиеся. Атомом металла.
Вывод: фенол – слабая кислота( её называют карболовой кислотой)
Демонстрационный эксперимент. В образовавшийся раствор фенолята натрия с помощью стеклянной трубочки пропускаем углекислый газ.
Учитель. Что наблюдаете?
Учащиеся. Помутнение раствора.
Запишите уравнение
Учитель. Что же образовалось в результате взаимодействия углекислого газа и воды?
C6H5ONa + CO2 +H2O = C6H5OH + NaHCO3
Образования малорастворимого фенола.
б) реакции электрофильного замещения.
Учитель. Изменяет ли окраску бромная вода в бензоле?
Учащиеся. Нет.
Демонстрационный эксперимент. Взаимодействие бромной воды с фенолом.(в вытяжном шкафу!).
Учитель. Что наблюдаете?
Учащиеся. Изменение окраски и выпадение белого осадка
Учитель. Образовался 2,4,6- трибромфенол.
А теперь постараемся записать уравнение этих реакций. А затем проверить их по учебнику.
Учащиеся пишут в своих тетрадях, один ученик возле доски.
в) реакции поликонденсации.
Фенол широко используется в промышленности, т.к. он может вступать в реакцию с формальдегидом с образованием фенолформальдегидной смолы.
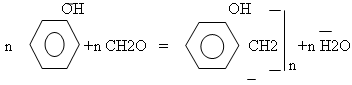
г) качественная реакция.
Учитель. Как можно различить фенолы от других веществ?
Учащиеся.качественной реакцией.
Демонстрационный эксперимент.
В раствор чистого фенола добавляем 2-3 капли хлорида железа(III), раствор окрашивается в фиолетовый цвет.
Эксперимент в группах.
1-3 группа делает опыт с чайной заваркой
2-4 группа с яблоком.
Каждая группа отчитывается о проделанной работе.
III. Получение и применение фенола.
Работа с учебником и дополнительной литературой.
Учитель. При нервных стрессах, что вырабатывается в нашем организме?
Учащиеся. Адреналин.
Учитель. Адреналин является многоатомным фенолом.
Как видите применение фенола очень велико. Поэтому для промышленных нужд используется фенол получаемый из каменноугольной смолы. Однако этот источник не может полностью удовлетворить потребности в феноле. Поэтому получают его синтетическим способом из бензола. Этот способ называют- кумольным. Сущность реакции заключается в окислении изопропил бензола кислородом воздуха. В этой реакции кроме фенола получают еще один ценный продукт – ацетон. (презентация).
Закрепление.
Работа с карточками по группам.
I гр. 1) Фенол может быть получен путем следующих превращений:
- C6H6
- C6H5Cl
- C6H5OH
Как вы предложили бы осуществить каждое из этих превращений? Составьте уравнение реакций.
II гр. Запишите уравнения реакций, с помощью которых можно осуществить цепочку уравнений:
Ацетилен бензол хлорбензол фенол 2,4,6 трибромфенол
III гр. Определите массовые доли веществ в растворе, полученном растворением 5,4 г орто-крезола в 100мл 5%-ного раствора гидроксида калия плотностью 1,04 г/мл.
Домашнее задание: $ 18 уп. 1, 3,4-письмено. Из дополнительной литературы, газет, статей приготовить сообщение о защите окружающей среды на примерах Селенгинского ЦКК, Гусиноозерской ГРЭС.