Цели урока:
-формирование понятия «амфотерность», применение знаний о кислотно-основных свойствах соединений.
Задачи урока:
-обеспечить усвоение свойств амфотерных соединений;
-обобщить сведения о характерных свойствах оксидов, кислот и оснований, подготовиться к выполнению практической работы;
-закрепить навык составления уравнений реакций;
-развивать умение анализировать информацию, выделять причинно-следственные связи;
-совершенствовать умение находить общие черты и различия в составе и свойствах веществ;
-поддерживать уверенность в своих силах;
-воспитывать навыки коллективной работы и внимательное отношение к мнению другого человека.
Тип урока:
Комбинированный урок изучения новых знаний и применения знаний, умений, навыков.
Этапы урока:
I. Организация начала урока.
Учитель: Ребята, сегодня нам предстоит подготовиться к практической работе по характерным свойствам изученных веществ (оксидов, кислот и оснований). Кроме того, мы познакомимся с веществами, которые обладают и кислотными, и основными свойствами, проявляя их в зависимости от того с чем реагируют. Вам предстоит серьёзная индивидуальная и групповая работа, а в качестве помощников мы используем систему цветных символов и схемы, отражающие химические свойства веществ.
В основе системы цветных символов лежит способность человека запоминать понятия и термины, ассоциируя их с цветом (например, название станций метрополитена часто ассоциируется с цветом ветки на схеме).
II. Проверка усвоения предыдущего материала.
Учитель: Для выполнения 1-го задания у вас на столах лежат карточки красного и синего цветов, на каждой карточке формула сложного вещества. Вещества разные, но относятся к одному классу, какому?
Ученики выясняют, что это оксиды (формулы кислотных оксидов стоит написать на красных карточках, а формулы основных оксидов на синих).
Учитель: Работать будем в парах, вам нужно написать уравнения реакций взаимодействия веществ, записанных на карточках, с водой. Каждая мини-группа должна составить 2 уравнения. На доске работать индивидуально будут два ученика, в их задачу входит написать реакцию взаимодействия оксида с водой и составить схему правила такого взаимодействия из отдельных слов. (Ученику, который пишет уравнение с кислотным оксидом предлагается работать красным маркером или мелом, а тому, у кого основный оксид, синим).
По ходу выполнения задания необходимо обсудить:
-состав основных оксидов;
-состав кислотных оксидов;
-результат взаимодействия оксидов с водой;
-какие кислотные и основные оксиды не взаимодействуют с водой;
-состав и правила составления формул оснований и кислот.
На доске должна появиться запись:
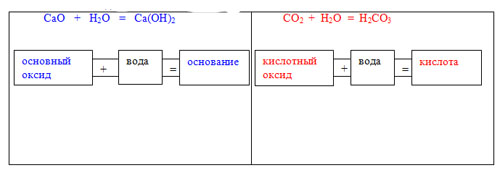
После выполнения задания необходимо обсудить:
-какие оксиды мы обозначили красным, а какие синим цветом;
-как на практической работе учащиеся смогут доказать, что полученное вещество является кислотой или основанием;
-что такое индикаторы и как они изменяют цвет.
III. Подготовка учащихся к сознательному усвоению новых знаний.
Учитель: Мы обсудили с вами как можно экспериментально доказать наличие полученной кислоты или щелочи, но сегодня наша работа теоретическая и нам предстоит выполнить 2-е задание. Теперь на развороте доски записаны схемы правил ( в тех же цветовых решениях), а вы постарайтесь подобрать примеры уравнений реакций. Работаем в группах, потом 2 человека выполняют задание у доски.
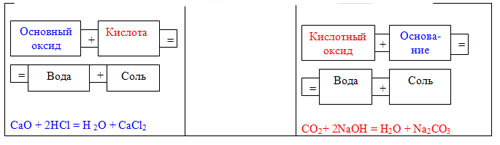
Эта схема ещё раз напоминает нам правило:
Наиболее типичными для соединений являются реакции взаимодействия с противоположными по свойствам веществами.
Учитель: Не случайно центральная часть доски у нас пока пустует. Там осталось место для особых соединений, их название произошло от греческого слова amphoteros, означающего « и тот и другой». Однокоренным к нему является слово амфибия, давайте вспомним, что оно значит?
IV. Изучение нового материала.
Амфотерность - способность соединений проявлять либо кислотные либо основные свойства, в зависимости от того с чем они реагируют.
Амфотерных соединений довольно много. Из оксидов двойственными свойствами обладают: оксид цинка, оксид алюминия, оксиды меди, оксиды олова, оксиды свинца, оксид железа (III) и др. (На доске можно записать формулы амфотерных оксидов)
Заменим в наших схемах таблички «основный оксид» и «кислотный оксид» на табличку «амфотерный оксид» и получим новые правила. Для выполнения 3-го задания используем схемы, записанные на доске.
3 задание: Зная, что оксид цинка является амфотерным, составьте уравнения реакций его взаимодействия с соляной кислотой и гидроксидом натрия.
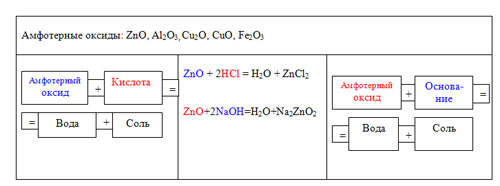
Учитель: С водой амфотерные оксиды не реагируют. Однако, сама вода является классическим примером амфотерного оксида, т.к. реагирует и с кислотными, и с основными оксидами.
V. Первичное осмысление знаний.
Учитель:Как же распознать, что соединение является амфотерным?
Амфотерный характер носят оксиды и гидроксиды большинства переходных элементов и многих элементов побочных подгрупп.
Для удобства определения характера соединений некоторые варианты таблицы Д.И.Менделеева снабжены цветными значками, похожими на те, которыми мы сегодня пользовались. Значок синего цвета я подпишу, а вы сами подпишите два других.

Помните, что оксиды и гидроксиды активных металлов всегда основны,
Соединения неметаллов обычно носят кислотный характер.
VI. Закрепление знаний.
Учитель: Ваше 4-е задание самое сложное, но если вы запомнили химические свойства оснований и кислот, то справитесь и с ним.
4-е задание: Запишите уравнения реакций взаимодействия амфотерного гидроксида цинка с кислотой и щелочью. Перед тем как вы начнете самостоятельную работу над этим заданием, я немного помогу.
Давайте вместе составим формулу гидроксида цинка Zn(OH)2. В таком виде мы привыкли записывать основания, но это же вещество можно изобразить и в виде кислоты, достаточно раскрыть скобки и перенести водород на первое место: H2ZnO2 . Такая кислота существует, она называется цинковая, а её соли- цинкаты.
VII. Контроль и самопроверка знаний.
Разбирая 4-е задание, стоит обратить внимание на:
-химические свойства кислот и оснований;
-составление названий солей;
-двоякость свойств амфотерных соединений.
Учащимся, которые быстро справились с заданием можно предложить выполнить задание из учебника после параграфа.
VIII. Обобщение и систематизация знаний.
Учитель: Для того, чтобы помочь себе запомнить правила написания продуктов реакции, существует много различных схем. Я приведу пример для оксидов, а вы попробуйте составить подобные схемы для кислот, оснований и амфотерных гидроксидов.
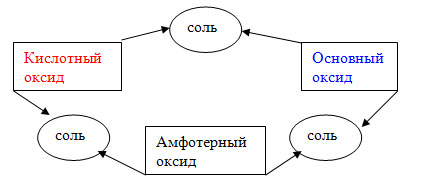
IX. Информация о домашнем задании, подведение итогов урока.
В качестве домашнего задания предлагается подготовиться к практической работе по теме: «Проведение химических реакций, характеризующих свойства веществ». Для выполнения практической работы можно использовать схемы, составленные на уроке.