“Акт удивления – есть начало процесса познания”
А.Эйнштейн.
С точки зрения усвоения “Молекулярная физика. Тепловые явления” является одним из самых сложных разделов:
1. Большое число понятий, величин, соотношений, постоянных, сконцентрированы на маленьком промежутке времени, выделяемого по программе.
2. Впервые ученикам приходится сделать резкий скачок от усвоения динамических закономерностей механики к статистическим.
3. Далеко не всем ученикам удаётся преодолевать психологический барьер перехода от реально ощутимых понятий механики к чисто абстрактным и т.д. Опыт показывает, что именно из-за указанных трудностей мы “приобретаем”, буквально на начальном этапе второго цикла изучения физики, учеников, которые “ничего не понимают”.
Однако, вопреки указанным сложностям (а скорее, благодаря им) изучение именно этого раздела позволяет ознакомить учащихся с мощным, но далеко не использованным аппаратом физики-методики научного познания мира; даёт им возможность самостоятельно ощутить всю мощь и силу теоретического предвидения новых, неизвестных закономерностей или подтверждение уже известных.
Учитывая вышеизложенное, нами были созданы 10 блоков многофункциональных задач по данному разделу, которые позволяют учащимся не изучать и запоминать, а самостоятельно исследовать, анализировать результаты и “открывать” определённые соотношения и закономерности. Центр тяжести усвоения перенесён от получения знаний в готовом виде (что по меткому выражению Эйнштейна лишает учащихся “переживания радости поисков и находок”), к теоретическому предвидению и экспериментальной проверке. Ученик проходит вместе с первооткрывателем весь его путь, “все муки творчества”.
Самой сложной из данного раздела является тема “Температура. Уравнение состояния”, поэтому мы и предлагаем её в сокращённом виде.
Предварительные замечания:
- Данный многофункциональный блок является неотъемлемой частью целой системы блоков раздела, поэтому некоторые величины используют из предыдущих блоков.
- Учитывая малый объем воздуха из стеклянной трубки, все расчёты проводятся с точностью до 3-4 значащих цифр.
- На изучение данного блока, учитывая особенности класса, можно использовать 2-4 урока.
Опыт:
Стеклянную трубку погружают в мензурку с водой на 2-3 см.Закрывая пальцем верхний её конец, добавляют горячую воду, сохраняя первоначальную глубину погружения и после достижения теплового равновесия между воздухом и водой измеряют: длину трубки l, высоту водяного столбика для двух состояниях воздуха h1 и h2 , радиус сечения трубки r, температуру холодной и горячей воды и атмосферное давление. Полученные результаты используются во всех исследованиях. В одном из опытов получены такие результаты:
t1=190 C
t2=280C
h1=2,5cм
h2=1,7cм
r=3,5мм
Р1=Рат=1,03*105 Па
V1=S(l-h1)=1,056*10-5м3
P2=Pa+pg (h1-h2)=1,0308*105Па
V2=S(l-h2)=1,0867*10-5м3
1. Выдвигается гипотеза о температуре как о средней кинетической энергии молекул газа и на её основании определяется данная величина, воспринимая её как температуру в Джоулях. Недостающие данные берут из предыдущих блоков.
![]() =
= ![]() = 5,72*10-21Дж;
m0=4,81*10-26кг; V=488
= 5,72*10-21Дж;
m0=4,81*10-26кг; V=488![]()
2. Анализ формулы кинетической энергии молекулы (температура в Дж) приводит к мысли о невозможности её экспериментальной проверки. Из основного уравнения МКТ получают новое выражение температуры в Дж. Вычисляя и сравнивая её с предыдущим значением, ученики приходят самостоятельно, используя результаты собственного эксперимента, к выводу о справедливости последней формулы.
Совпадение теоретических и практических результатов подтверждают справедливость последней формулы, но пока не подтверждает гипотезы о прямой пропорциональности между температурой и средней кинетической энергией молекул.
P=![]() m0 n V2
m0 n V2![]() =
=![]() = 5,82*10-21Дж;
= 5,82*10-21Дж; ![]() 2%
2%
Число молекул воздуха N=![]() , где Vо1 – объем приходящий
на одну молекулу (Vо1=3,75*10-26м3 –
из предыдущих блоков); N=2,8*10-20
, где Vо1 – объем приходящий
на одну молекулу (Vо1=3,75*10-26м3 –
из предыдущих блоков); N=2,8*10-20
Продолжая придерживаться указанной гипотезы, делают вывод о прямой пропорциональности между температурой и новым выражением. Мы предлагаем специально затягивать введение абсолютной температуры Т. Позже, получая неожиданно очень большие значения этой величины, учащиеся вынуждены будут признавать необходимость её введения.
3. Настал момент экспериментального определения постоянной Больцмана. Напоминают учащимся об одном свойстве пропорции. Если две величины прямо пропорциональны, то и их соответствующие изменения так же будут прямо пропорциональны. Умножая правую часть на коэффициент пропорциональности К ,
приходят к выводу, что данная постоянная
численно равна изменению температуры в Дж(![]()
![]() ), рассчитанной на температуру в1оС
.Определяют, используя результаты эксперимента,
значение постоянной.
), рассчитанной на температуру в1оС
.Определяют, используя результаты эксперимента,
значение постоянной.
![]()
![]()
![]()
![]() t;
t; ![]()
![]() =К
=К![]() t; К=
t; К=![]() ;
;
![]() 1=
1=![]() =3,86*10-21Дж ;
=3,86*10-21Дж ;
![]() 2=
2=![]() =3,98*10-21Дж;
=3,98*10-21Дж;
К=![]() =1,333*10-23
;
=1,333*10-23
;
![]() =
=![]()
4. Решая простую систему уравнений, где используются результаты эксперимента, учащиеся определяют температуры воздуха из стеклянной трубки. Полученные результаты для них неожиданны большие. Теперь настал самый подходящий момент, чтобы они самостоятельно ввели понятие об абсолютной температуре, о точке её отсчёта, о формуле перехода температур, сравнение и уточнение полученных температурах, а также абсолютную их погрешность, что убеждают их в степени точности проделанных опытов и расчётов.
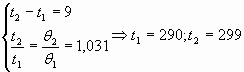
Сравнивая первоначальные температуры воздуха (19 и 28) с полученными (290 и 299), находят их разницу: 299-19=271; 299-28=271 и делают выводы: Гипотеза о прямой зависимости между температурой и средней кинетической энергии молекул подтверждается, если ввести новую шкалу температур, отличающийся от привычной на 271 (по результатам эксперимента).
Из ![]() =КТ
получают Р=nКТ и определяют температуру воздуха
при нормальных условиях Т=
=КТ
получают Р=nКТ и определяют температуру воздуха
при нормальных условиях Т=![]() =273К После этого легко найти
формулу перехода температур, ввести шкалу
Кельвина и определять их значения для воздуха.
Т=t+273;Т1=t1+273=19+273=292;T2=t2+273=28+273=301;
=273К После этого легко найти
формулу перехода температур, ввести шкалу
Кельвина и определять их значения для воздуха.
Т=t+273;Т1=t1+273=19+273=292;T2=t2+273=28+273=301;
![]() =0,6%
=0,6%
5. Можно предложить учащимся получить точное значение постоянной Больцмана, что должно убедить их в не противоречивости полученных ими закономерностях.
T=0 273+t=0 точка отчета абсолютной температуры t=-273o
C К=![]() =1,38*10-23
Дж/К
=1,38*10-23
Дж/К
6. Предлагается проверить первоначальную гипотезу о пропорциональности температуры и средней кинетической энергии и найти с какой точностью данная гипотеза подтверждена экспериментально.
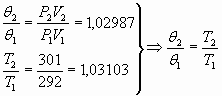 ,подтверждается
с очень большой точностью
,подтверждается
с очень большой точностью ![]() =0,1%
=0,1%
7. Полученное экспериментальное доказательство прямой пропорциональности между средней кинетической энергии молекул и температурой приводит учащихся к мысли, что должна существовать ещё одна формула энергии молекул, связанной только с температурой. Предлагается ученикам найти её и вычислить ещё одним способом тепловую энергию молекул, сравнивая между собой все полученные результаты.
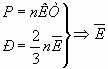 =
=![]() ;
;
![]() =
=![]() ;
;
![]() ;
;
![]() =
=![]() ;
;
![]()
8. Предлагается найти теоретически уравнение Менделеева, затем, записав его два раза, для двух состояний газа, получить уравнение Клапейрона. Используя результаты эксперимента, проверить справедливость последней и процентное отклонение постоянной величины С.
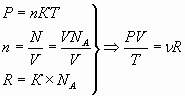 ;
;
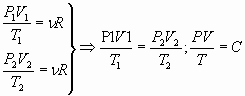 ;
;
![]()
![]()
![]()
9. Сравнивая правые части уравнения состояния, используя значение постоянной С, определяют универсальную газовую постоянную.
Сравнивают её с реальной, полученной на основании её определения и определяют процентное отклонение.
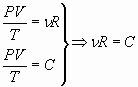 ;
;
R=![]() ;
;
![]() ;
;
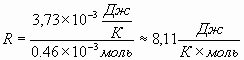 ;
;
![]()
10. Появление газовой постоянной даёт возможность получить новую формулу скорости молекул, более удобную, чем полученную раннее, из основного уравнения МКТ.
![]() =
=![]()
![]() =
=![]() ;
; ![]() =500
=500![]()
В ходе данного исследования учащиеся постоянно убеждаются в роли теоретических предсказаний, которые подтверждаются экспериментально.
Было бы непростительно, если не воспользоваться возможностями, предоставленные особенностями “Молекулярной физики” для ознакомления их с мощным, но мало использованным аппаратом познания природы.
11. Подставляя в уравнении P= nKT формулу концентрации молекул, выражают из неё число молекул для двух разных состояний и предлагают определить соотношение числа молекул при одинаковых объёмах, давлениях и температурах.
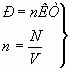
![]() ;
; ![]()
Считаем: ученикам необходимо напоминать, что закон Авогадро есть следствие из уравнения состояния, о чём, сам Авогадро, естественно, ещё не знал. А уравнение состояния – это следствие из определения температуры как меры средней кинетической энергии молекул.
12. Убедиться в невероятных возможностях
предсказаний теоретических исследованиях
позволяет следующее: Предлагают ученикам
теоретически найти парциальные![]() давления азота и кислорода,
используя их массовые доли в воздухе.
давления азота и кислорода,
используя их массовые доли в воздухе.
mN=0,76 mв
m0=0,24 mв
Ра=105 Па
Для этого, из уравнения PV=NKT выражают давление и записывают его для азота, кислорода и воздуха.
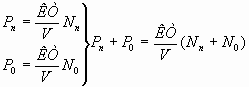 ;
;
Nn+N0=Nв; 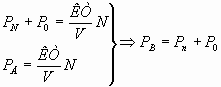 – закон Дальтона. Конкретно: PN=
– закон Дальтона. Конкретно: PN=![]() ;
;
P0=![]() ;
;
PB=PN+P0=0,78PB+0,22PB (теоретическое предвидение неизвестного закона.)
Подведем некоторые итоги.
Не смотря на хаос, царящем в мире молекул, они “признают” и подчиняются определённым закономерностям:
1) Молекула “знает”, что при изменении
температуры на 1К её энергия должна изменится
ровно на ![]() , а
группа молекул из NA=6,02*1023 изменит при
этом свою энергию ровно на
, а
группа молекул из NA=6,02*1023 изменит при
этом свою энергию ровно на ![]() .
.
2) При любых изменениях параметров газа (Р,V,Т)
молекулы обязаны вести себя так, чтобы созданные
ими самими давление, объём и температура не
нарушали уравнение состояния ![]() .
.
Однако, мы вынуждены напомнить, что все
исследования были проведены с воздухом, который
состоит, в основном, из азота и кислорода.
Молекулы воздуха – это молекулы - фантомы, их в
реальности не существует. Для самых любопытных
учащихся можно предложить такой вопрос: А
“захотят” ли реальные молекулы азота или
кислорода подчинятся указанным закономерностям?
Ведь компоненты воздуха, не смотря на их тепловое
равновесие отличаются молярной массой,
скоростью и массой молекул, парциальным
давлением и т.д. И самое главное: сохранится ли
выражение ![]() для всех компонентов воздуха постоянной?
для всех компонентов воздуха постоянной?
Для доказательства равенства величины ![]() для всех газов
авторы учебника предлагают громоздкий и
невыполнимый в школе опыт с тремя газами (H2, O2,
Hе), которых искусственно подвергают переходу
в разные состояния. В предлагаемом простом опыте
воздух из стеклянной трубки, вернее, его
компоненты, постоянно находятся в тепловом
равновесии. Сама природа предлагает
использовать этот факт, позволяя учащимся
самостоятельно убедится в справедливости очень
важного предположения, на котором строятся все
полученные закономерности, а именно:
неизменности величины
для всех газов
авторы учебника предлагают громоздкий и
невыполнимый в школе опыт с тремя газами (H2, O2,
Hе), которых искусственно подвергают переходу
в разные состояния. В предлагаемом простом опыте
воздух из стеклянной трубки, вернее, его
компоненты, постоянно находятся в тепловом
равновесии. Сама природа предлагает
использовать этот факт, позволяя учащимся
самостоятельно убедится в справедливости очень
важного предположения, на котором строятся все
полученные закономерности, а именно:
неизменности величины ![]() при тепловом равновесии всех газов.
при тепловом равновесии всех газов.
13. Используя предыдущие данные предлагается учащимся ответить на заданный вопрос для каждого газа. Рациональнее использовать групповой метод – каждая группа исследует поведение одного компонента воздуха.
Предлагаются следующие этапы исследования:
- Оценить значение постоянной Больцмана, температуры воздуха по абсолютной шкале.
- Доказать, что температуры компонентов воздуха не отличаются от температуры воздуха при одинаковых состояниях.
- Проверить справедливость уравнения состояния
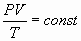 .
. - Оценить значение универсальной газовой постоянной.
Приводим наше исследование, в качестве примера,
для азота. Парциальное давление компонентов
воздуха (азот, кислород, аргон), а также их массы
молекул и массовые доли - из “Справочника по
физике и технике, Е.С. Еноховича”. Число молекул
компонентов определяется на основании их
массовой доли: m1=0,76mВ – для азота; m1=m01*N
1; mВ=mОВ*NВ; Тогда m01*N
1=0,76mОВ*N В![]() .
.
Давление компонентов Р1=0,78РВ – для азота.
Для наглядности и систематизации, лучше представить результаты в виде таблицы:
t1=19oC |
t2=28oC |
К*10-23
|
Т1, К |
Т2, К |
 t1=19oC |
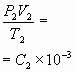 t2=28oC |
R,
|
|
| Воздух | 3,86 | 3,98 | 1,33 | 290 | 299 | 3,725 | 3,722 | 8,11 |
| Азот | 3,83 | 3,95 | 1,33 | 290 | 299 | 2,925 | 2,922 | 8 |
| Кислород | ||||||||
| Аргон |
Предлагаем уважаемым коллегам, самостоятельно убедится, что и для других компонентов воздуха указанные закономерности справедливы.
Несмотря на легкость и простоту опытов, предлагаемый путь усвоения данной темы, на наш взгляд, позволяет учащимся самостоятельно теоретически предсказывать и экспериментально подтверждать (“открывать”):
- Существование энергетического эквивалента температуры;
- Гипотезу о температуре, как о мере средней кинетической энергии молекул;
- Неизменность величины
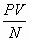 для любых газов при их тепловом
равновесии;
для любых газов при их тепловом
равновесии; - Необходимость введения абсолютной шкалы температуры;
- Неизменность величины
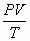 при переходе газа в разных
состояниях для постоянной их массы;
при переходе газа в разных
состояниях для постоянной их массы; - Значения постоянной Больцмана К и универсальной газовой постоянной R.
Абсолютные погрешности полученных результатов составляет 2-3%.