Актуальность темы. Использование межпредметной связи на уроках химии способствует более глубокому и успешному усвоению программного материала. Учащиеся приобретают и совершенствуют практические умения выявлять причинно-следственные связи между явлениями, процессами. При этом создаются благоприятные условия для осмысленного понимания фактов, теорий, законов, а также конкретизации и упрочения ранее приобретенных знаний по химии, физике и биологии, условий для логического завершения формирования знаний.
Наиболее четко межпредметные связи просматриваются между химией, биологией, физикой как предметами естественного цикла, формирующую целостную картину окружающего мира.
Расчеты растворов играют важную роль в медицине, а также при определении количественного состава биологического материала и физиологических функций химических компонентов превращения веществ в живых организмах и значении этих явлений. Данная разработка предлагается в ходе изучения программного материала для 10-х классов по теме “Раствор и электролитическая диссоциация” (Казахстан).
Цель деятельности педагога. Интеграция школьных естественнонаучных предметов для дальнейшего развития и совершенствования химического образования в школе.
Цель урока. Систематизация, углубление знаний о растворах как основы жизнедеятельности клеток организма.
Дидактические задачи. Обобщение знаний учащихся о растворах, осуществление коррекции знаний, создание условий для этих знаний применения при изучении цитологии, закрепление умений решать расчетные задачи.
Воспитательные задачи. Формирование умений работать самостоятельно и в малых группах способствует развитию навыков само- и взаимоконтроля, сотрудничества и чувства ответственности основано на принципе сочетания коллективных и индивидуальных форм обучения.
Развивающие задачи. Развитие логического мышления, а именно синтетико-аналитического на основе выполнения практических заданий, а также познавательного интереса к естественным наукам, формирование целостной картины мира.
Научные задачи. Развитие навыков синтезировать и анализировать материал, формирование научной картины окружающего мира, формирование исследовательской культуры.
Оборудование: интерактивная доска, химические реактивы, посуда и т.д.
Нужно использовать презентационный материал, содержащий комментарии, объяснения и т.д. в ходе урока (тема, цель, задачи урока слайды 1-4). Презентация
План урока.
- Организационный момент.
- Ориентировочно-мотивационный этап.
- Операционно-исполнительский этап.
- Рефлексивно-оценочный этап.
- Подведение итогов.
ХОД УРОКА
- Организационный момент.
Приветствие класса, создание благоприятного климата для успешной учебной деятельности, обозначение темы, актуальность ее и цели урока.
- Ориентировочно-мотивационный этап.
Актуализация прежних знаний: способы выражения содержания растворенного вещества в растворе. Устный опрос теоретического материала с проверкой. (Слайды 5,6,7,8).
- Дайте определение понятию “массовая доля”.
- Что такое “молярная доля”? как ее рассчитывать?
- Что вы понимаете под термином “молярность”? Есть ли синонимы данного понятия?
- Какие типы концентраций вы знаете? Раскройте суть.
ПЕРВОЕ НАПРАВЛЕНИЕ. РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНО-РАСЧЕТНЫХ ЗАДАЧ ПО РАСТВОРАМ.
Оборудование: штатив с пробирками, растворы хлорид бария, серная кислота, коническая колба, воронка, фильтровальная бумага, стеклянная палочка, спиртовка, спички, держатель для пробирок, мерный цилиндр (слайд 9).
ЗАДАЧА № 1 - определение массы вещества по заданной концентрации (слайд 10)
Условие задачи: Получите сульфат бария реакцией обмена между растворами хлорида бария и серной кислотой и выделите его из смеси. Вычислите массу 20% раствора серной кислоты, вступившей в реакцию, если образовалось 23,3 г сульфата бария.
Ученики решают задачу, получив нужное количество серной кислоты, проводят эксперимент: получают сульфат бария и выделяют его из смеси фильтрованием.
ДАНО:
m (BaSO4) = 23,3
![]()
m (20% раствора H2SO4) - ?
РЕШЕНИЕ: BaCl2 + H2SO4= BaSO4![]() +2HCl
+2HCl
m (20% раствора H2SO4)=(9,8 20) ![]() 100=49 (г)
100=49 (г)
ОТВЕТ: масса 20% раствора серной кислоты равна 49 г.
ЗАДАЧА № 2 - определение объема раствора по известной его концентрации (слайд 11)
ВТОРОЕ НАПРАВЛЕНИЕ. РОЛЬ РАСТВОРА В ЖИВЫХ РАСТИТЕЛЬНЫХ КЛЕТКАХ
Индивидуальные клетки обмениваются веществами с окружающей средой в результате таких физических процессов как диффузия и осмос (слайд12).
ОПЫТ № 1 Изучение осмоса в живых растительных клетках.
Материал и оборудование: эпидермис (кожица) лука или молодого ревеня, микроскоп, 2 покровных и 2 предметных стекол, скальпель, пинцет, дистиллированная вода, 1М раствор сахароза, 2 пипетки с грушей, фильтровальная бумага.
Методика проведения опыта (слайд 13,14).
Скальпелем и пинцетом отделите полоску эпидермиса с нижней поверхности луковицы или с черенка листа ревеня. Быстро перенесите оторванную полоску эпидермиса на предметное стекло и капните на него 2-3 капли дистиллированной воды. Накройте покровным стеклом и посмотрите, как выглядят клетки эпидермиса под микроскопом. Зарисуйте несколько разных клеток.
Скальпелем отделите другую полоску эпидермиса с нижней поверхности луковицы или с черенка листа ревеня. Повторите всю процедуру, капнув вместе воды 1М раствора сахарозы. Понаблюдайте под микроскопом за ней в течение 15 минут при большом увеличении. Зарисуйте происходящие изменения в одной или нескольких клетках.
Проведем эксперимент наоборот. Последнюю полоску под микроскопом необходимо дистиллированной водой промыть для удаления раствора сахарозы. Затем избыток жидкости убрать фильтрованной бумагой.
ПРИМЕЧАНИЕ. Учащиеся должны определить, какие процессы происходили с полосками эпидермиса луковицы (ревеня). А именно: плазмолиз – протопласт под действием раствора сахарозы сморщивается и отстает от клеточной стенки; обратный процесс – деплазмолиз (слайд 15).
ОПЫТ № 2. Определение среднего осмотического давления клеточного сока в препарате растительных клеток методом начинающего плазмолиза
Материал и оборудование: черенок ревеня или луковица, микроскоп, 4 чашки Петри, 4 пробирки, штатив для пробирок, этикетка или восковой карандаш, 2 градуированные пипетки на 10 или 25 мл, 2 стакана на 100 мл, тонкая кисточка для рисования, скальпель, тонкий пинцет, дистиллированная вода, 1М раствор сахарозы, предметно и покровное стекла, миллиметровка (слайд 16).
Методика проведения опыта.
- Подпишите 4 чашки Петри и 4 пробирки для следующих растворов сахарозы – 0,3; 0,4; 0,5; 0,6 М
- Возьмите градуированную пипетку на 10 или 25 мл, стакан дистиллированной воды и стакан 1М раствора сахарозы и приготовьте в пронумерованных пробирках по 20 мл раствора сахарозы различной концентрации. В таблице 1 даны объемы для приготовления этих растворов.
Таблица 1 – Приготовление разбавленных растворов сахарозы для опыта № 2 (слайд 17)
| Концентрация раствора, М | Объем дистиллированной воды, мл | Объем 1М раствора сахарозы, мл |
| 0,3 | 14 | 6 |
| 0,4 | 12 | 8 |
| 0,5 | 10 | 10 |
| 0,6 | 8 | 12 |
- Хорошо перемешайте каждый раствор путем встряхивания пробирки, вылейте растворы в соответствующие чашки Петри.
- ЛУК. Оторвите одну мясистую чешую луковицы, из
внутреннего эпидермиса вырезать 4 квадратика
размером 5
 5 мм, положить
по одному в каждую чашку Петри. Оставить на 20
минут.
5 мм, положить
по одному в каждую чашку Петри. Оставить на 20
минут.
РЕВЕНЬ. Прорежьте в наружном эпидермисе 4 квадратика размером 5 5
мм, отделите их и т.д. как описано для лука.
5
мм, отделите их и т.д. как описано для лука. - С помощью кисточки выньте ткань из 0,6 М раствора сахарозы и перенесите ее на предметное стекло, капните 2-3 капли раствора сахарозы той же концентрации. Накройте покровным стеклом и рассмотрите под микроскопом.
- При малом увеличении выберите подходящую зону клеток. Затем используйте объектив для среднего и большого увеличения и просмотрите выбранную зону, передвигая стекло. Запишите, в каком состоянии (плазмолизированном или нет) первые 100 просмотренных клеток. Клетку считают плазмолизированной, если протопласт в ней хотя бы чуть-чуть отошел от клеточной стенки.
- Повторите всю процедуру с остальными квадратиками ткани в соответствующих растворах.
- Подсчитайте процент плазмолизированных клеток в каждом растворе. Постройте график, отложив по вертикальной оси процент плазмолизированных клеток, а по горизонтальной оси – молярность раствора сахарозы.
- По графику определите молярность раствора сахарозы, при которой плазмализировались 50% клеток, участвующих в процессе.
- Постройте график зависимости осмотического давления (по вертикали) от молярности раствора сахарозы (по горизонтали), используя данные таблицы 2.
Таблица 2 – Осмотическое давление растворов сахарозы при 20° С (слайд 18)
| Концентрация раствора, М | Осмотическое давление, кПа | Осмотическое давление, атм. |
| 0,3 | 820 | 8,1 |
| 0,4 | 1120 | 11,1 |
| 0,5 | 1450 | 14,3 |
| 0,6 | 1980 | 19,5 |
- Из полученного графика определите осмотическое давление того раствора, который вызывает 50% плазмолиз. Эта величина соответствует усредненному осмотическому давлению клеточного сока.
Сходные результаты получаются с эпидермисом ревеня.
- Рефлексивно-оценочный этап (слайд 19).
- Расскажите, как произвести плазмолиз опытным путем?
- В чем суть деплазмолиза?
- Существует ли зависимость между количеством плазмолизированных клеток и молярностью раствора сахарозы? Какая?
- Дайте определение диффузии. Что такое “осмос”?
- Как зависит осмотическое давление от концентрации раствора сахарозы?
- Какое значение имеют растворы в жизнедеятельности клеток организма?
ЗАДАЧА. Содержание белка в организме человека составляет 17 % от массы тела. Азота в белке содержится 16%. Определить массу азота в собственном организме, исходя из массы твоего тела (кг).
В процессе анализа задачи необходимо обратить внимание на химический состав белков, их строение, на обязательное присутствие в белке азота.
Пример решения задачи (слайд 20).
ДАНО:
mт = 70 кг
![]() =0,17
=0,17
![]()
ma - ?
РЕШЕНИЕ
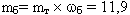 (кг) – масса
белка в организме
(кг) – масса
белка в организме-
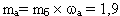 (кг) масса
азота в организме
(кг) масса
азота в организме
ОТВЕТ: масса азота в организме равна 1,9 кг.
Подведение итогов.
Обобщение результатов проведенной работы, выставление отметок, запись домашнего задания.
ЛИТЕРАТУРА
- Ахметов Н.С., Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по неорганической химии. – М.: Высшая школа, 1988 – 112 с.
- Грин Н., Стаут У., Тейлор Д. Биология /Перевод с англ. / Под ред. Р.Сопера – М.: Мир, 1990. – Том 2. – 155 с.
- Нурахметов Н.Н., Бекишев К.Б., Заграничная Н.А. Химия. Учебник для 10 класса естественно-математического направления общеобразовательных школ. – А.: Мектеп баспасы, 2006
- Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. – М.: Высшая школа, 1987
- Бекишев К.Б.
 –
А.: Мектеп баспасы, 1995
–
А.: Мектеп баспасы, 1995