Цели: сформировать у учащихся представление о кислотах (составе, классификации, представителях);
- продолжить работу по развитию умения составления формул химических соединений: бинарных соединений, оснований;
- отработать умения определять степени окисления;
- изучить правила техники безопасности, при работе с кислотами.
Оборудование: НСl, H2SO4 (в растворе и концентрированная), лакмус, фенолфталеин, метиловый оранжевый, пробирки, штатив, стеклянная палочка, лучинка, универсальная индикаторная бумага, аскорбиновая кислота (на столах учащихся); инструкция «Техника безопасности при работе с кислотами»; таблица «Изменение окраски индикаторов в зависимости от среды», таблица «Кислоты»
На доске: карта путешествия по «Стране кислот», вывески с названиями станций. (Приложение)
Ход урока
I. Организационный момент.
II. Актуализация знаний учащихся.
Учитель. У нас сегодня весьма необычный урок, нам предстоит увлекательнейшее путешествие в мир кислот. Но прежде чем отправиться в путь, необходимо проверить, все ли готовы к путешествию. Это будет непростая прогулка. В дороге вас ждут испытания, преодолеть которые можно только с помощью знаний, полученных на уроках химии. Обычно в дорогу берут багаж. Давайте проверим ваш багаж знаний.
Фронтальный опрос.
- Какие вещества называют бинарными?
- Что называют оксидами?
- Какие вещества называют основаниями?
- На какие группы можно разделить основания?
Самостоятельная работа.
1. Составьте формулы соединений, образованных атомами:
1-й ряд: водорода и хлора; магния и кислорода.
2-й ряд: водорода и серы; кальция и хлора.
3-й ряд: фосфора и кислорода; азота и водорода.
Назовите эти соединения.
2. Определите С.О. элементов в следующих веществах:
1-й ряд: N2, AlCl3, RClO3
2-й ряд: Fe, SiF4, Na2SO3
3-й ряд: O3, SO2, H4P2O7
3. Запишите формулы оснований:
гидроксид натрия, гидроксид калия, гидроксид цинка, гидроксид свинца
Проверка производится сразу после выполнения заданий по рядам. Кто быстрее и правильно выполнил задания, тот отправляется в первом вагоне, затем – во втором и третьем.
Учитель. Итак, все готовы к путешествию, в путь-дорогу друзья, вперед!
III. Изучение нового материала.
1. Первая остановка – «Дегустационная».
Учащиеся должны убедиться в том, что большинство кислот кислые на вкус.
Учитель.!!! В химическом кабинете ничего нельзя пробовать на вкус.
Это грубейшее нарушение ПТБ. Но сегодня перед вами лежит таблетка
аскорбиновой кислоты, ее (в виде исключения) можно попробовать. Кроме того, вспомните вкус клюквы, щавеля, уксуса.
(Учащиеся записывают вывод.)
– Все кислоты кислые на вкус. (Салициловая – сладкая, никотиновая – горькая)
(Поезд отправляется дальше, следующая остановка будет «Правила техники безопасности».)
2. Вторая остановка – «Правила техники безопасности».Учащиеся знакомятся с «Инструкцией по технике безопасности при работе с кислотами».
Правила техники безопасности (инструкция)
При работе с кислотами необходимо соблюдать некоторые правила техники безопасности:
- Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
- Заполнять пробирку можно только на 1/3 объема.
- Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
- При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать концентрированную кислоту с водой следует с большой осторожностью:
вливать серную кислоту в воду, а не наоборот. Если вливать воду в
серную кислоту, то часть воды за счет выделения теплоты может нагреться до кипения. Кислота начнет разбрызгиваться и может попасть на кожу, в глаза. - Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором
Учитель проводит демонстрационный опыт растворения в воде концентрированной H2SO4.
Наблюдается сильное разогревание пробирки. Фиксирует внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, оказывается на поверхности, закипает, и ее брызги вместе с кислотой могут обжечь лицо и руки.
Запомни:
Сначала – вода,
Затем – кислота –
Иначе случится беда! (Запись в тетрадях)
3. Третья станция – «Информационная».
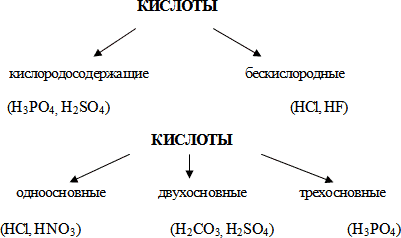
Учитель знакомит учащихся с определением кислот, с важнейшими представителями кислот, формулами, названиями.
Учитель. Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
Общую формулу кислот можно записать так: НnКоn- , где H- атом водорода, Ко -кислотный остаток, n – индекс (количество атомов водорода), n- – заряд кислотного остатка.
| HNO3 – азотная кислота | HCl – хлороводородная кислота | |
| HNO2 – азотистая кислота | HF – фтороводородная кислота | |
| H2SO4 – серная кислота | ||
| H2SO3 – сернистая кислота | ||
| H2CO3 – угольная кислота | ||
| H2SiO3 – кремниевая кислота | ||
| H3PO4 – фосфорная кислота |
Заранее подготовленные учащиеся дают краткую информацию о кислотах.
Что такое кислота.
Ученик. Серная кислота (H2SO4) относится к неорганическим кислотам. Это вязкая бесцветная жидкость. Концентрированная серная кислота гигроскопична, поэтому применяется для осушки газов. Серная кислота реагирует с металлами (кроме золота и платины). Широко используется в промышленности. Из нее получают минеральные удобрения, взрывчатые вещества, краски, лекарства, ее используют для обогащения руд. Эту кислоту называют кровью химии.
Ученик. Соляная кислота – сильная кислота, растворяет многие металлы. В больших количествах потребляется в химической, металлургической промышленности. Соляная кислота содержится в желудочном соке и играет важную роль, так как способствует перевариванию пищи и убивает различные болезнетворные бактерии. При недостаточной кислотности желудочного сока внутрь принимают разбавленный раствор НСl, а при повышенной концентрации НСl в желудке ощущается изжога.
Ученик. Одним из важнейших для техники химических соединений является азотная кислота. Она расходуется при выработке взрывчатых веществ, органических красителей, пластических масс. Смесь концентрированной азотной (HNO3) с концентрированной соляной (НСl) называют царской водкой, в ней
растворяется даже «царь» металлов – золото. Смесь действует значительно энергичнее, чем каждая из входящих в нее кислот в отдельности.
Алхимики изображали этот процесс символически, в виде льва, пожирающего солнце. (Золото считалось металлом Солнца).
Ученик. Борная кислота используется как дезинфицирующее средство, в промышленности используется при эмалировании железных сосудов, она входит в состав эмалей.
Углекислый газ, растворенный в воде, образует угольную кислоту. На хорошей растворимости углекислого газа основано его использование при изготовлении искусственных минеральных вод и прохладительных напитков, например лимонада. Органические кислоты более слабые. Так, хорошо знакомый нам уксус ни что иное как растворенная в воде уксусная кислота.
Ученик. Ацетилсалициловая кислота – это ни что иное, как хорошо известный всем аспирин. Многие кислоты, необходимые для жизнедеятельности, вырабатываются организмом человека. Часть кислот человек получает с пищей или в виде витаминов (аскорбиновая кислота, никотиновая кислота, фолиевая кислота и др.). Необходимые организму аминокислоты человек
получает с белковой пищей.
Ученик. Лимонная кислота присутствует в плодах лимонов, яблочная – в яблоках, щавелевая – в листьях щавеля.
В свежем молоке есть чуть меньше 1% лимонной кислоты, а в кисломолочных продуктах (кефире, твороге) образуется молочная кислота.
Кислоты представляют собой жидкости или твердые вещества. Например, лимонная, винная и стеариновая кислоты – твердые.
4. Четвертая станция – «Индикаторная».
Заранее подготовленные учащиеся дают краткую информацию об истории открытия индикаторов. Затем класс проводит соответствующие опыты и самостоятельно делает вывод о том, что индикаторы изменяют свой цвет в растворах кислот. Это общее свойство кислот, которое обусловлено особенностями в их строении.
Индикаторы («указатели») – вещества, которые под действие кислот и щелочей изменяют свой цвет. Открыты Р. Бойлем.
Лабораторная работа.
На столах учащихся: индикаторы – лакмус фиолетовый, метиловый оранжевый, фенолфталеин, универсальный индикатор, пробирки под номерами 1, 2, 3. В первой пробирке – кислота, во второй – щелочь, в третьей – вода.
Задание. Используя таблицу «Изменение окраски индикаторов в зависимости от среды», распознать, в какой пробирке находится кислота.
Вывод в тетради учеников: «Минеральные и органические кислоты проявляют общие свойства, обусловленные общностью их строения».
Учитель. – Итак, наше путешествие по стране кислот подходит к концу, и нам нужно возвращаться.
III. Закрепление.
Учитель снимает вывески с названием станции и читает вопрос, учащиеся отвечают на него.
а) Информационная.
б) Дегустационная станция.
– Что о кислотах вы узнали на этой станции?
– Правильно ли утверждение: «Вещество можно определить по вкусу: если оно кислое - это кислота»?
в) ПТБ.
– Какие существуют меры предосторожности при работе с кислотами?
г) Индикаторная станция.
– Какие вещества называются индикаторами?
– Кто открыл индикаторы?
– Какую кислоту индикаторы помогли открыть Р. Бойлю?
* * * * *
Не страшны кислоты мне,
Даже очень сильные.
Но в растворах щелочей
Становлюсь малиновый.
Ярче сока всех малин, Кто я?
(Фенолфталеин)
В щелочах я очень желтый,
А в кислотах очень красный.
А в среде нейтральной –
Цвет оранжевый, прекрасный.
Индикатор очень важный, Как зовусь я?
(Метиловый оранжевый.)
Эта желтая бумажка
Все покажет без труда:
Посинеет – в колбе щелочь,
Покраснеет –кислота,
Коль нейтральная среда –
Не изменит цвет тогда.
Мы за эти указания
Как зовем ее? (Универсальная.)
IV. Подведение итогов урока.
Учитель. Сегодня мы изучили новый класс веществ, который называется кислоты. Я думаю, что путешествуя, вы приобрели знания, которые пригодятся вам в жизни.
V. Домашнее задание:
§ 20, стр.74, упр.1, 2, 3.
В заключение учитель благодарит детей за активное участие в уроке, выставляет оценки.