Тип урока: Урок усвоения новых знаний.
Форма урока: Урок – лекция.
Цели урока:
1. Повторить материал, изученный на уроках химии в 9 классе об озоне, как аллотропном видоизменении кислорода.
2. Раскрыть сущность глобальной экологической проблемы – истоньшения озонового слоя.
3. Развитие познавательного интереса к экологической дисциплине у учащихся.
4. Формирование всесторонне развитой, гармоничной личности.
Изучив материал, учащиеся должны будут:
1. Знать:
- Сущность экологической проблемы.
- Схему образования озона в атмосфере.
- Азотный цикл разрушения озона.
- Водородный цикл разрушения озона.
- Хлорный цикл разрушения озона.
2. Уметь:
- Прогнозировать изменения в живой природе, к которым ведёт экологическая проблема.
- Предлагать пути решения проблемы.
- Писать уравнения реакции образования озона в атмосфере.
- Составлять уравнения реакций, соответствующих циклам разрушения озона в атмосфере.
Фронтальная работа с классом:
1. Определение темы урока.
2. Выявление цели урока.
3. Регламент работы на уроке*.
4. Изложение материала в форме лекции учителем – дублёром (учеником).
В силу достаточно большого объёма, громоздкости материала рекомендуется отводить на изучение темы урока 50 минут учебного времени, причём начать урок следует не с проверки заданного к уроку домашнего задания (если таковое было задано), а с определения темы (совместно с учащимися) и непосредственного изложения материала в лекционной форме.
ХОД УРОКА:
На доске написана тема урока и число.
На магнитной доске написан, или напечатан на листе бумаги в компьютерном исполнении новый для учащихся термин “Озоновая дыра”.
Учитель-дублёр начинает урок с небольшого введения о глобальных экологических проблемах современности, возникших по вине человека, акцентирует внимание учащихся на планетарном характере этих проблем, на возможности их решения только усилиями многих или даже всех стран мира, на необходимости незамедлительного решения их.
Далее осуществляется плавный переход к теме урока и вводится понятие:
Озоновая (озонная) дыра – значительное пространство в озоносфере планеты с заметно пониженным (до 50%) содержанием озона. Это явление лишь часть сложной экологической проблемы истощения озонового слоя Земли. В результате антропогенных факторов – выбросов в атмосферу фреонов (ХФУ – хлорфторуглеводородов) и оксидов азота (продуктов неполного сгорания органического топлива сверхзвуковых самолётов и космических аппаратов), начались процессы разрушения или истощения озонового слоя нашей планеты.
Учащиеся записывают термин под диктовку учителя-дублёра.
На доске заранее чертится схема строения атмосферы, на перечерчивание которой в рабочую тетрадь, учитель – дублёр даёт классу 3 минуты. В процессе работы учащихся, дублёр определяет положение озонового слоя на схеме, акцентирует внимание учащихся на мизерной его толщине и огромной роли для всего живого на планете (защите жизни от губительных жёстких ультрафиолетовых лучей).
Затем учитель-дублёр предлагает классу вспомнить материал курса неорганической химии 9 класса. Учащиеся называют формулу озона, вспоминают понятие аллотропии. (Явления, при котором один и тот же химический элемент образует несколько простых веществ. ) Простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями этого элемента. Для кислорода это О2 – молекулярный кислород и О3 – озон, определяют особенности строения молекулы озона и её образование в атмосфере при грозовых разрядах:
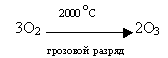
Учитель дублёр раскрывает сложный механизм образования озона в атмосфере уже с позиций ученика 10 класса:
![]()
Где![]() -
квант света, а О* - свободный радикал
кислорода
-
квант света, а О* - свободный радикал
кислорода
Далее образующиеся радикалы кислорода либо соединяются между собой, образуя молекулярный кислород:
О* + О* = О2, либо взаимодействуют с молекулой кислорода, образуя молекулу озона:
О2 + О* = О3
Образовавшийся озон под влиянием внешних условий разрушается (диссоциирует):
![]()
Либо, будучи химически активным, радикал кислорода и молекула озона взаимодействуют между собой с образованием молекулярного кислорода:
О3 + О* = 2 О2
Такая схема поведения озона в естественных условиях впервые предложена английским геофизиком С.Чепменом в 1930 году.
Учащиеся переписывают схему в тетрадь.
Учитель – дублёр продолжает рассказ о трёх циклах разрушения озона в атмосфере уже по вине человека (схемы можно заранее написать на доске или нанести на полиэтиленовую плёночку и проецировать на экран с помощью кодоскопа).
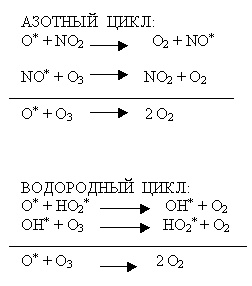
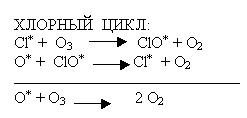
Пока учащиеся переписывают схемы циклов в тетрадь, учитель-дублёр поясняет уравнения реакций: в первых двух реакциях каждого цикла озон реагирует с веществом (частицей), которое в ходе химических реакций никуда не исчезает, так если в первой реакции каждой схемы оно вступает в процесс, то во второй реакции оно образуется в первоначальном виде. Подобные вещества в науке называются катализаторами. Вспоминаем из курса химии 9 класса совместно с учащимися термин катализатор. (Задействованы межпредметные связи.)
Катализатор – вещество, ускоряющее ход химической реакции, но само при этом не расходующееся.
Таким образом, попадание в верхние слои атмосферы даже незначительного количества веществ, разрушающих озоновый слой, может длительное время влиять на баланс озона.
Далее учащиеся перечерчивают в тетрадь схему, которую так же можно заранее начертить на доске, либо спроецировать с полиэтиленовой плёнки на экран при помощи кодоскопа. (Приложение1.)
Пути решения проблемы (учитель-дублёр акцентирует внимание учащихся на необходимости скорейшего решения данной проблемы с привлечением сил всех стран мира):
1975 год – всемирная метеорологическая организация (ВМО) впервые выступила с заявлением о воздействии на озоновый слой результатов деятельности человека и о вероятных геофизических последствиях этого воздействия.
1977 год - по инициативе ЮНЕП (программа ООН по вопросам охраны окружающей среды) в Вашингтоне было созвано специальное совещание экспертов по озону. Был выработан и принят “Мировой план действий по озоновому слою”, который реализуется и сейчас в рамках международного сотрудничества.
1985 год - в Вене подписана конвенция по охране озонового слоя.
1987 год - в Монреале было принято международное соглашение по уменьшению и дальнейшему отказу от производства веществ, разрушающих озон.
1990 год - в Лондоне на собрании представителей стран, подписавших Монреальский протокол, были приняты поправки, существенно усилившие ограничения на использование фреонов.
1992 год - в Копенгагене представители 91 страны мира провели очередную конференцию по озоновому слою с целью ускорить полное прекращение производства фреонов. Были приняты решения к 1996 году полностью прекратить производство наиболее опасных видов фреонов, а до 2030 - всех остальных. Было выделено 240 миллионов долларов для помощи развивающимся странам с тем, чтобы они прекратили производство фреонов до 2010 года.
В наше время практически во всех экономически развитых странах, а так же в Китае и Индии принимаются меры по предотвращению и смягчению последствий озонового истощения.
Учитель-дублёр подводит итоги урока, напоминает основные ключевые вопросы, рассмотренные в ходе урока-лекции, задаёт домашнее задание – выучить изложенные материал для рассказа на следующем уроке.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА.
1. Н. Ф. Реймерс, Природопользование, Словарь – справочник, М., “Мысль”, 1990
2. С. В. Алексеев, Экология, учебные пособия для 9, 10 - 11 классов, Санкт Петербург, СМИО ПРЕСС, 1999.
3. Н. Ф. Винокурова, В. В. Трушин, учебник для 10 – 11 классов профильных школ, М., “Просвещение”, 1998.
4. В. А. Вронский, Экология, словарь-справочник, Ростов-на-Дону, М., “Зевс”, 1997
5. Б. А. Быков. Экологический словарь, Алма-Ата, Наука, 1988.
6. В. А. Вронский, прикладная экология, Учебное пособие, Ростов-на-Дону, “Феникс”, 1996.
7. И. И. Дедю, Экологический энциклопедический словарь, Кишинёв, 1989.
8. Ю. Одум. Экология, перевод с англ., Т. 1 – 2, М., Мир, 1986.
9. Рудзитис Г. Е., Фельдман Ф. Г., Химия 9, М., Просвещение, 1989.
10. Словарь химических терминов под ред. Бусева А.И., М., Просвещение, 1971.
11. Гузей Л. С. и другие, Школьный учебник Химия-9, М., “Дрофа”, 2002.