Цели занятия:
1) провести комплексный анализ реакции Fe 3+ + NCS – с точки зрения кинетики, механизма, строения продукта реакции и практической значимости;
2) продолжить формирование химической речи учащихся, творческого мышления, правил научного общения;
3) провести качественное и полуколичественное определение Fe3+ в нескольких средах; формирование умений наблюдать и объяснять химические явления; развитие умений анализировать результат наблюдаемых опытов.
Оборудование: растворы FeCl3, KNCS, KCl, K2SO4, NaCl, Na2SO4, NaF, растворы солей магния, кальция, бария, алюминия, цинка, меди, хрома(III), марганца(II), кобальта(II), никеля(II), свинца(II).
Эпиграф: “Исследовать – значит видеть то, что видели все, и думать так, как не думал никто”. А. Сент – Дьерди.
Ход урока:
Учитель: Вы уже обратили внимание на тему нашего урока “Бенефис качественной реакции”? Вам знакомо слово “бенефис”? Что оно означает?
Бенефис – театрализованное представление в честь одного из участников.
Учитель: Почему такое необычное сочетание “бенефис качественной реакции”?
Химическая реакция как процесс превращения веществ одна из основных составляющих предмета химии. На каждом уроке мы наблюдаем, описываем и объясняем разнообразные химические реакции. Поэтому и сегодня главным участником нашего занятия будет химическая реакция. Но не обычная реакция, а качественная.
Что мы называем качественной реакцией?
Качественная реакция – химическая реакция, позволяющая определить состав вещества.
Учитель: Итак, вот она – главная участница нашего бенефиса
Fe 3+ + NCS – =
Кстати, слово “бенефис” произошло от французского “benefice” – барыш, прибыль, польза. И это еще один повод назвать наш урок именно так, потому что польза для каждого из нас очевидна:
1) возможность совершенствовать навыки
химического эксперимента;
2) определим содержание Fe3+ в различных
источниках;
3) объясним сущность данного процесса.
Может быть, кто-то из вас захочет продолжить исследование, начатое сегодня.
Действие первое “чисто химическое”.
На сцене появляется сама реакция.
Демонстрация 1.
На демонстрационном столе стаканы с растворами солей железа(III), магния, кальция, бария, алюминия, цинка, меди, хрома(III), марганца(II), кобальта(II), никеля(II), свинца(II).
К каждому раствору добавить 1 мл раствора тиоцианата калия.
Учитель: Какие произошли изменения? Можно ли использовать взаимодействие солей железа(III) с тиоцианатом калия как качественную реакцию на ионы Fe3+?
Только продукт взаимодействия ионов железа Fe3+ с тиоцианат-ионом дает продукт кроваво-красного цвета, следовательно реакция FeCl3 с KNCS является качественной на ионы Fe3+.
Таким образом, с помощью тиоцианат-иона можно однозначно определить наличие ионов Fe3+ в исследуемом веществе.
Любая качественная реакция имеет так называемый предел обнаружения – минимальную концентрацию вещества, которая может быть обнаружена с помощью данного реагента.
Каков же предел обнаружения ионов Fe3+ с помощью тиоцианат-иона?
Групповая лабораторная работа.
Цель: в ходе совместной работы составить колориметрическую шкалу для определения концентрации ионов железа(III).
На столах раствор хлорида железа(III), содержащий 100 мг/л Fe3+. Последовательным разбавлением учащиеся готовят растворы, содержащие 10 мг/л, 1 мг/л, 0,5 мг/л, 0,1 мг/л Fe3+.
При взаимодействии раствора KNCS и растворов FeCl3 различной концентрации получаем колориметрическую шкалу.
Концентрация Fe3+, мг/л |
Окраска раствора |
| 100 | Буро-красная |
| 10 | Темно-красная |
| 1 | Розовая |
| 0,5 | Светло-красная |
| 0,1 | Отсутствует |
Но какую пользу может принести любая, даже самая эффектная химическая реакция, если она существует ради самой себя, не служит человеку. Все это можно сказать о какой-нибудь другой химической реакции, но только не о нашей. Данная реакция используется для качественного и количественного определения Fe3+ в различных средах.
Действие второе “биологическое”.
Учитель: Попробуем применить нашу реакцию для определения железа в некоторых продуктах питания. Без железа не может функционировать организм человека, животных, растений. Какова же биологическая роль железа?
Примерное содержание сообщения ученика: “В биологических системах железо связано с органическими веществами. Содержание железа в организме человека составляет 0,01%. Железо незаменимо в процессах кроветворения и внутриклеточного обмена. Примерно 55% железа входит в состав гемоглобина эритроцитов, около 24% участвует в формировании красящего вещества мышц (миоглобина), примерно 21% откладывается “про запас” в печени и селезенке. Суточная потребность взрослого здорового человека в железе составляет 10–20 мг и восполняется сбалансированным питанием. В случае большого недостатка железа в организме возникает заболевание – железодефицитная анемия (малокровие). Избыточное количество железа приводит к образованию нерастворимого в воде железосодержащего белка. Этот белок уже не может быть использован организмом и, откладываясь в тканях и органах, вызывает нарушение их функций и приводит к заболеванию”.
Учитель: Наличие достаточного количества железа в пище – непременное условие здорового образа жизни. И здесь нам на помощь придет наша реакция.
Групповая лабораторная работа.
Цель: определить содержание железа в некоторых продуктах питания.
Материалы: яблоки, гречиха, курага.
Предварительная подготовка: в ступке измельчить образцы анализируемых продуктов одинаковой массы, добавить 10 мл азотной кислоты, 1–2 мл пероксида водорода. Полученную смесь перетереть и перенести в стакан.
Отобрать по 2 мл экстракта добавить 1 каплю 20%–ного раствора тиоцианата калия.
Сравнить окраску полученных растворов с колориметрической шкалой. Сделать вывод об относительном содержании железа в исследуемых продуктах питания.
Учитель: Нередко можно услышать такой совет: “Ешьте побольше яблок, особенно антоновку: они очень богаты железом и витамином С”. На самом деле яблоки не особенно богаты железом. Более того, они содержат его порой меньше, чем другие продукты питания. Другое дело, что соли железа, содержащиеся в яблоках, лучше усваиваются организмом, поскольку они находятся в благоприятном соотношении с витаминами. Но это касается вообще всех сортов яблок, а не только антоновских.
Как уже было сказано, при недостатке железа в организме развивается заболевание железодефицитная анемия. Примерно оценить обеспеченность организма железом можно с помощью следующего теста.
Тест “Порядок ли у вас с железом”.
На вопросы отвечайте либо “да”, либо “нет”.
1. Часто ли вы чувствуете усталость и подавленность?
2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
3. Теряли ли вы в последнее время много крови?
4. Занимаетесь ли вы профессиональным спортом?
5. Вы редко или совсем не едите мясо?
6. Выпиваете ли вы более трех чашек чая или кофе в день?
7. Вы едите мало овощей?
Если на большинство вопросов вы ответили “нет”, то ваш организм в достаточной степени обеспечен железом.
Учитель: Может быть содержание каких-либо вопросов вас заинтересовало с точки зрения влияния на содержание железа в организме?
Демонстрация 2.
К 20 мл чая добавить 5 мл раствора хлорида железа, содержащего 10 мг/л железа. Контрольный раствор 20 мл воды и 5 мл раствора хлорида железа (10 мг/л железа).
Раствор чая чернеет. Профильтровать полученный раствор. К фильтрату и к контрольному раствору добавить 1 каплю 20%-ного раствора тиоцианата калия. Отметить различную окраску растворов. В зависимости от крепости чая, происходит либо полное связывание ионов железа(III), либо значительное уменьшение их концентрации.
Учитель: Компоненты чая связывают железо в труднорастворимую форму. Чашка чая, выпитая во время еды, сократит усвоение железа почти на 2/3. Если чай выпит после приема пищи, то организм недосчитается 40% железа, а если – за 1 ч до еды, он оставит железо в неприкосновенности. Кроме чая, “врагами” железа являются кофе, молочные продукты и яичные желтки. Если с железом у вас все в порядке, то можно спокойно есть продукты, которые числятся во “врагах” железа. Если же нет, то необходимо изменить свой образ жизни.
Действие третье – “гидрологическое”.
Примерное содержание сообщения ученика: “В земной коре содержится 5,65% железа. Биомасса Земли, содержащая до 10 млрд. тонн железа, является важнейшим фактором миграции и перераспределения элемента в природе. В результате выветривания и частичного растворения горных пород в природных водах концентрация железа в них колеблется от 0,01 до 26 мг/л.
Концентрация ионов железа в природных водах значительно повышается за счет антропогенных источников. В экологической литературе существует понятие “железнение среды”, характеризующий возрастание объема антропогенного железа в природной среде.
В воде железо находится в виде солей Fe3+. ГОСТ разрешает содержание железа в питьевой воде до 0,3 мг/л, а если нет станции обезжелезивания, то до 1мг/л. Если содержание железа превышает указанную величину, то это отрицательно сказывается на органах пищеварительной и сердечно-сосудистой системы. При повышении ПДК вода приобретает специфический привкус и бурый цвет”.
Для контроля концентрации Fe3+ в воде опять на помощь придет качественная реакция.
Групповая лабораторная работа.
Цель: определить содержание Fe3+ в воде, взятой из различных источников.
Материалы: пробы водопроводной воды, взятые в разных местах, речная вода, родниковая вода, болотная вода.
Предварительная подготовка: к пробе воды (100 мл) добавить 1–2 мл концентрированной азотной кислоты для предотвращения гидролиза солей железа. Пробы воды готовятся за 5–10 часов до анализа.
На столах у учащихся в пронумерованных пробирках находятся приготовленные пробы воды. В каждую пробирку добавить по 1 капле 20%–ного раствора тиоцианата калия.
Отметить цвет раствора. Сравнить интенсивность окраски полученных растворов с колориметрической шкалой. Сделать вывод о концентрации ионов железа в исследуемых водах.
Заполнить таблицу:
Объект исследования (источник воды) |
Визуальный эффект |
Примерная концентрация Fe3+, мг/л |
| Болото | Буро-красный раствор | 100 |
| Школьный водопровод | Светло-розовая | 0,5 |
| Сельский водопровод 1 | Светло-розовая | 0,5 |
| Сельский водопровод 2 | Розовая | 1 |
| Родник 1 | Отсутствует | менее 0,5 |
| Родник 2 | Светло-розовая | 0,5 |
| Река Пут | Розовая | 1 |
Действие четвертое, “теоретическое”.
А теперь давайте попробуем объяснить, что же происходит при взаимодействии ионов Fe3+ и тиоцианат-ионов.
Рассмотрим реакцию более подробно.
Запишем уравнение реакции между ионами железа(III) и тиоцианат-ионами.
Fe3+ + 3 NCS– = Fe(NCS)3
Составим молекулярное уравнение этой реакции.
FeCl3 + 3 KNCS = Fe(NCS)3 + 3 KCl
Найдите уравнение этой реакции в учебнике. Все ли правильно у нас записано?
![]()
Дайте полную классификационную характеристику этой реакции.
Реакция обмена, протекает без изменения степеней окисления атомов, гомогенная, обратимая, некаталитическая.
Какой продукт реакции имеет окраску?
Хлорид калия – белое кристаллическое вещество, следовательно Fe(NCS)3 придает окраску раствору.
Так как эта реакция обратима, в реакционной среде устанавливается состояние равновесия, т.е. в растворе одновременно присутствуют как ионы исходных веществ, так и ионы продуктов реакции, то есть, чтобы получить более окрашенный раствор (увеличить концентрацию Fe(NCS)3), нужно сместить состояние равновесия вправо.
Какие условия влияют на состояние химического равновесия?
Температура, давление, концентрация веществ.
Какие из перечисленных факторов будут влиять на протекание рассматриваемой реакции?
Температура и концентрация веществ.
Для изучения механизма реакции исследуем влияние концентрации исходных веществ и продуктов реакции на состояние химического равновесия.
Демонстрация 3.
К раствору хлорида железа(III) добавить раствор тиоцианата калия, полученный раствор разбавить и разлить в четыре пробирки.
В первую пробирку добавить раствор хлорида железа(III), во вторую – тиоцинат калия, в третью – хлорид калия.
Наблюдения: в первой и во второй пробирках интенсивность окраски раствора увеличилась, следовательно, произошло повышение концентрации Fe(NCS)3, т.е. равновесие реакции сместилось вправо. В третьей пробирке интенсивность окраски раствора ослабла, следовательно, концентрация Fe(NCS)3 понизилась, т.е. равновесие реакции сместилось влево.
Таким образом, мы экспериментально подтвердили выполнение принципа Ле Шателье, определяющего направление смещения химического равновесия в результате внешних воздействий на реакционную систему.
Теперь давайте рассмотрим данную реакцию с точки зрения теории электролитической диссоциации. Запишем ионные уравнения.
Чтобы правильно выполнить это задание, нужно вспомнить правило Бертолле, которое определяет условия протекания реакций ионного обмена.
Реакции ионного обмена протекают, если ионы исходных веществ выводятся из сферы реакции в виде нерастворимого, газообразного или малодиссоциирующего вещества.
В рассматриваемой реакции не наблюдается ни выделение газа, ни образование осадка. Следовательно, условием ее протекания является образование малодиссоциирующего вещества. Какой из продуктов реакции Fe(NCS)3 или КCl является слабым электролитом.
Хлорид калия – сильный электролит, т.к. это соль с большой долей ионной связи и хорошо растворима в воде. Значит слабый электролит – Fe(NCS)3.
![]()
![]()
Полученное сокращенное ионное уравнение отражает сущность рассматриваемой реакции, т.е. происходит связывание ионов железа Fe3+ и тиоцианат-ионов в малодиссоциирующее вещество. Это уравнение хорошо объясняет смещение равновесия вправо при добавлении в систему веществ, содержащих Fe3+ и NCS – .
Почему же тогда добавление хлорида калия приводит к кажущемуся смещению равновесия реакции влево?
Учащиеся выдвигают свои гипотезы.
Все гипотезы можно записать на доске, а затем организовать их обсуждение.
Хлорид калия при растворении в воде диссоциирует на ионы К+ и Cl –. Может быть, имеет смысл выяснить, какой из этих ионов влияет на смещение равновесия и, следовательно изменение окраски раствора.
Как следует поступить?
Можно взять соли, содержащие по одному из этих ионов.
Демонстрация 4.
К исследуемой системе добавить хлорид натрия (ионы хлора) и сульфат калия (ионы калия).
В обоих случаях наблюдается снижение интенсивности окраски исходного раствора.
Проверим влияние соли, не содержащей ионов К+ и Cl –.
К реакционной системе добавить сульфат натрия.
Наблюдается снижение интенсивности окраски исходного раствора.
Попробуем добавить в реакционную среду соль, не содержащую одинаковых с хлоридом калия ионов, например нитрат натрия, сульфат натрия.
Демонстрация 5.
Эксперимент проводится в несколько параллелей. К реакционной системе добавить нитрат натрия, сульфат натрия. Можно использовать другие соли.
Результат оказывается тем же самым – происходит ослабление окраски раствора.
Введение любой соли, кроме солей железа и тиоцианатов, приводит к тому же результату – окраска раствора ослабляется.
В чем же дело? Почему во всех случаях наблюдается изменение окраски раствора? Может быть принцип Ле Шателье не применим к данной реакции.
Чтобы разобраться в возникшей неопределенности, необходимо составить теоретическую модель процессов, происходящих в ходе реакции.
В водном растворе ионы железа находятся в гидратированной форме в виде комплексной частицы с лигандами – молекулами воды.
![]()
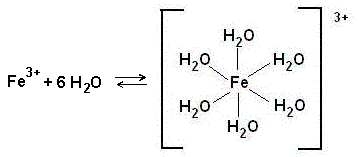
При внесении в раствор тиоцианат-ионов они, как более сильные лиганды, вытесняют молекулы воды.
![]()
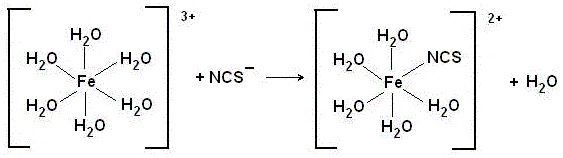
Присутствие даже одного тиоцианат-иона во внутренней сфере комплекса [Fe(NCS)(H2O)5]2+ приводит к появлению окраски раствора. Чем больше тиоцианат-ионов войдет во внутреннюю сферу комплекса, тем интенсивнее будет окраска раствора. Число тиоцианат-ионов во внутренней сфере комплекса зависит от силы находящихся в растворе лигандов и их концентрации.
Таким образом, при введении в раствор KCl, NaCl происходит частичное замещение NCS – на Cl –. Но NCS – более сильные лиганды, чем Cl –, поэтому мы наблюдаем лишь ослабление окраски раствора. Если ввести в систему ионы F – , то мы увидим полное обесцвечивание раствора, т.к. лиганды F – значительно сильнее, чем NCS – .
Демонстрация 6.
К исследуемой системе добавить раствор NaF.
Происходит полное обесцвечивание раствора.
Действие пятое, “заключительное”.
Изучив реакцию между хлоридом железа(III) и тиоцианатом калия, мы можем правильно записать ее уравнение:
![]()
На примере одной реакции мы с вами показали, что не нужно принимать любую информацию как истину в последней инстанции, даже если она написана в учебнике. Очень многое в них записано упрощенное, а потому и не совсем точно. Мы должны научиться ставить вопросы, видеть проблемы и пытаться решить их.
Закономерности протекания рассматриваемой реакции могут быть объяснены с использованием более глубоких представлений о состоянии вещества в растворе, но это уже совсем другая история.
Список литературы.
1. Зайцев О.С. Методика обучения химии. – М.:
“Владос”, 1999.
2. Ивченко Л.А., Макареня А.А. Валеология на уроках
неорганической химии // Химия. – 2000. – № 26.
3. Харьковская Н.Л., Лященко Л.Ф., Волынцева Н.А.
Железо и окружающая среда // Химия в школе. – 1998. –
№ 5.